گلیسین (اسید آمینه استیک، گلیکوکول، Gly، G). خواص شیمیایی نمک سدیم اسید آمینه
I. با تعداد گروه های عملکردی
مونوآمینومونو اسیدهای کربوکسیلیک
ساده ترین نماینده:

اسیدهای مونوآمینو دی کربوکسیلیک

به عنوان مثال:

اسیدهای دی آمینو مونو کربوکسیلیک

به عنوان مثال:

II. توسط موقعیت متقابلگروه های کربوکسیل و آمینو
-آمینو اسیدها

- اسیدهای آمینه β

- اسیدهای آمینه γ

فرمول ها و نام برخی از اسیدهای آمینه α که بقایای آنها بخشی از پروتئین ها هستند

پروتئین ها پلیمرهای طبیعی هستند که درشت مولکول های آن ها از آن ساخته شده اند تعداد زیادیباقیمانده 20 اسیدآمینه مختلف. در بیوشیمی معمولاً از اسامی کوتاه و بی اهمیت و سه حرفی برای اسیدهای آمینه استفاده می شود.
اسیدهای مونوآمینو مونو کربوکسیلیک
|
اسید آمینه اتانوئیک یا آمینو استیک یا گلیسین (گلیکوکول) |
|
|
2-آمینوپروپانوئیک یا α-آمینوپروپیونیک اسید یا آلانین |
|
|
2-آمینو-3-هیدروکسی پروپانوئیک یا α-آمینو-β-هیدروکسی پروپیونیک اسید یا سرین |
|
|
2-آمینو-3-مرکاپتوپروپانوئیک اسید، یا بتا-مرکاپتوآلانین، یا سیستئین |
|
|
2-آمینو-3-فنیل پروپانوئیک اسید، یا بتا- فنیل آلانین، یا فنیل آلانین |
|
|
اسید 2-آمینو-3-(4-هیدروکسی فنیل)-پروپانوئیک، یا β-(n-هیدروکسی فنیل)-آپانین، یا تیروزین |
|
|
اسید 2-آمینو-3-متیل بوتانوئیک یا α-آمینو ایزووالریک اسید یا والین |
اسیدهای مونوآمینو دی کربوکسیلیک
دی آمینومونو کربوکسیلیک اسید
طبقه بندی اسیدهای آمینه طبیعی
I. آمینو اسیدهای قابل تعویض - می توانند در بدن انسان سنتز شوند. از جمله موارد فوق می توان به اسیدهای گلیسین، آلانین، سرین، سیستئین، تیروزین، آسپارتیک و گلوتامیک اشاره کرد.
II. آمینو اسیدهای ضروری در بدن انسان نمی توانند سنتز شوند و باید به عنوان بخشی از پروتئین های غذایی به بدن عرضه شوند. فنیل آلانین، والین، لیزین نمایندگان اسیدهای آمینه ضروری هستند.
خواص فیزیکی
اکثر اسیدهای آمینه بی رنگ هستند مواد کریستالی، بسیار محلول در آب است. بسیاری از اسیدهای آمینه طعم شیرینی دارند. نقطه ذوب اسیدهای آمینه مختلف بین 230-300 درجه سانتیگراد است.
خواص شیمیایی
اسیدهای آمینه ترکیبات آمفوتری هستند که به دلیل وجود گروه های عاملی اسیدی (-COOH) و بازی (-NH 2) در مولکول های آنها است.
1. تعامل با پایگاه ها

2. تعامل با اسیدها

3. تشکیل نمک های داخلی (یون های دوقطبی)
در محلول های آبی، اسیدهای آمینه به شکل مخلوط مولکول های تعادلی و یون های دوقطبی وجود دارند که محیط اسیدیبه شکل کاتیونی منتقل می شود و در محیط قلیایی- به شکل آنیونی
الف) اسیدهای مونوآمینو مونو کربوکسیلیک

هنگامی که نمک های داخلی اسیدهای مونوآمینو مونو کربوکسیلیک تشکیل می شوند، ماهیت محیط تغییر نمی کند. بنابراین به این آمینو اسیدها خنثی می گویند. بار کل نمک های داخلی چنین اسیدهایی صفر است.
هنگامی که یک اسید (H+) اضافه می شود، یون کربوکسیلات پروتونه می شود و تنها یک بار مثبت روی گروه -NH باقی می ماند.
ب) اسیدهای مونوآمینو دی کربوکسیلیک

هنگامی که نمک های داخلی اسیدهای مونوآمینو دی کربوکسیلیک تشکیل می شود، یون های هیدروژن اضافی تشکیل می شود، بنابراین محلول های آبی این اسیدها دارای pH هستند.
ج) اسیدهای دی آمینو مونو کربوکسیلیک

هنگامی که نمک های داخلی اسیدهای دی آمینو مونو کربوکسیلیک تشکیل می شوند، یون های هیدروکسید اضافی تشکیل می شوند، بنابراین محلول های آبی آنها دارای pH > 7 هستند. این گونه اسیدهای آمینه بازی نامیده می شوند. بار کل نمک های داخلی اسیدهای آمینه بازی مثبت است.
4. تشکیل پپتید
هنگامی که گروه کربوکسیل یک مولکول اسید آمینه با گروه آمینه یک مولکول اسید آمینه دیگر برهمکنش می کند، دی پپتیدها تشکیل می شوند:

هنگامی که دو آمینو اسید مختلف با هم تعامل می کنند، مخلوطی از چهار دی پپتید تشکیل می شود. به عنوان مثال:

یک دی پپتید با افزودن یک مولکول اسید آمینه دیگر می تواند یک تری پپتید تشکیل دهد. به طور مشابه، یک تتراپپتید را می توان از یک تری پپتید و غیره به دست آورد.
5. تشکیل مشتقات در گروه کربوکسیل
مانند اسیدهای کربوکسیلیک، اسیدهای آمینه می توانند استرها، کلریدهای اسیدی و غیره را تشکیل دهند. به عنوان مثال:

6. چند متراکم شدن ε-آمینوکاپروئیک اسید

روش های به دست آوردن
1. آمونولیز اسیدهای آلفا هالوکربوکسیلیک
2. هیدرولیز پروتئین
اسیدهای آمینه – اینها مشتقاتی از اسیدهای آلی حاوی یک یا چند گروه آمینه (NH 2) در رادیکال هستند.
با توجه به نامگذاری منطقی، نام آنها دارای پیشوند "آمینو" و حروف الفبای یونانی (α-، β-، γ-، و غیره) است که نشان دهنده موقعیت گروه آمینه در رابطه با گروه کربوکسیل است.
4-آمینوبوتان
(γ-آمینوبوتیریک)
پروتئین ها حاوی اسیدهای آمینه α هستند که نام های کمی دارند.
اسیدهای آمینه به مونوآمینوکربوکسیلیک، دی آمینو کربوکسیلیک، آمینودی کربوکسیلیک، معطر و هتروسیکلیک تقسیم می شوند: CH3 –CHNH2 –COOH آلانین (α-آمینوپروپیونیک اسید) دی آمینوکاپروئیک اسید)؛ COOH-CH 2 -CHNH 2 -COOH آسپارتیک اسید (آ-آمینو سوکسینیک اسید). C6H5-CH2-CHNH2-COOH فنیل آلانین (α-آمینو-β-فنیل پروپیونیک اسید).

(پیرولیدین-α-کربوکسیلیک اسید).
همه اسیدهای آمینه α، که اغلب در موجودات زنده یافت می شوند، دارای نام های بی اهمیتی هستند که معمولاً در ادبیات استفاده می شود.
خواص اسیدهای آمینهآمینو اسیدها مواد کریستالی هستند که معمولاً طعمی شیرین دارند و به راحتی در آب حل می شوند.
بسته به تعداد گروه های عامل آمینه یا کربوکسیل در یک اسید آمینه، می تواند دارای خواص بازی (لیزین) یا اسیدی (اسید آسپارتیک) باشد.
گروه آمینه و گروه کربوکسیل قادر به تشکیل یک یون دوقطبی یا نمک داخلی هستند:
NH 2 –CH 2 –COOH →NH 3 + –CH 2 –COO – .
وجود گروه های –NH 2 و –COOH در آمینو اسیدها خواص آمفوتریک آنها را تعیین می کند (آنها هم با بازها و هم با اسیدها برهم کنش دارند).
H 2 N-CH 2 -COOH + NaOH → H 2 N - CH 2 -COONa + H 2 O
نمک گلیسین سدیم
H 2 N-CH 2 -COOH +HCl→Cl -
نمک هیدروکلراید گلیسین
اسیدهای آمینه با الکل ها استرها را تشکیل می دهند.
H 2 N-CH 2 -COOH + NOCH 3  NH 2 – CH 2 – COOCH 3 + H 2 O
NH 2 – CH 2 – COOCH 3 + H 2 O
متیل استر گلیسین
تشکیل نمک های مس داخل کمپلکس مشخص است. از این واکنش می توان برای جداسازی اسیدهای آمینه استفاده کرد.

نمک گلیسین مس
هنگامی که گرم می شود، اسیدهای آمینه α به 1،4-دیکتوپی پرازین تبدیل می شوند.

β  -اسیدهای آمینه با حرارت دادن به راحتی آمونیاک را از دست می دهند و اسیدهای غیر اشباع را تشکیل می دهند.
-اسیدهای آمینه با حرارت دادن به راحتی آمونیاک را از دست می دهند و اسیدهای غیر اشباع را تشکیل می دهند.
اسید اکریلیک
γ، δ، ε-اسیدهای آمینه هنگامی که گرم می شوند به آمیدهای حلقوی - لاکتام ها تبدیل می شوند.

ε-آمینوکاپروئیک اسید کاپرولاکتام
عمده این محصول برای تولید الیاف پلی آمید - نایلون استفاده می شود.
اسیدهای آمینه حاوی یک گروه آمینه در موقعیت α تحت یک واکنش کم آبی برای تشکیل پلی پپتید قرار می گیرند.
گلیسین آلانین سیستئین
نام پلی پپتید از نام رادیکال های اسیدی و نام کامل اسیدی که گروه کربوکسیل در آن ذخیره می شود تشکیل شده است.
روش های به دست آوردن.اسیدهای آمینه را می توان با هیدرولیز پروتئین ها یا از اسیدهای هالوژنه تحت تأثیر آمونیاک به دست آورد:
α-بروموپروپیونیک اسید آلانین
اسیدهای آمینه α بخشی از پروتئین غذا هستند و به دو دسته قابل تعویض و غیر قابل تعویض تقسیم می شوند.
آمینو اسیدهای غیر ضروری را می توان توسط بدن انسان یا حیوان سنتز کرد. اسیدهای آمینه ضروری (متیونین، والین، لوسین، فنیل آلانین، ایزولوسین، تریپتوفان، لیزین، ترئونین) در یک ارگانیسم زنده تشکیل نمی شوند و برای عملکرد طبیعی آن باید با غذا تامین شوند. به عنوان مثال، کمبود لیزین بر عملکرد خونساز و کلسیفیکاسیون استخوان تأثیر می گذارد. متیونین اثر ضد اسکلروتیک دارد. تریپتوفان برای فرآیند رشد و متابولیسم مهم است.
منبع طبیعی اسیدهای آمینه α، مواد پروتئینی هستند (در طول هیدرولیز).
اسیدهای آمینه بخشی از گیاهان، میکروارگانیسم ها، حیوانات و انسان هستند و نقش بسیار زیادی در فرآیندهای زندگی موجودات دارند.
سنجاب ها – اینها ترکیبات آلی طبیعی حاوی نیتروژن با مولکولی بالا هستند که مولکولهای آنها از اسیدهای آمینه α که توسط پیوندهای پپتیدی به هم متصل شده اند ساخته شده اند، یعنی پروتئین ها پلی پپتید هستند.
تعادل تعادل تعادل
آلانین سرین سیستئین
پروتئین ها به طور گسترده در طبیعت به ویژه در حیوانات و انسان ها توزیع می شوند. مقدار زیادپروتئین ها در استخوان ها، غضروف ها، ماهیچه ها و بافت های عصبی یافت می شوند. پروتئین ها مو، پشم، پر، فلس ماهی، سم، شاخ و غیره را تشکیل می دهند. پروتئین ها در تخم پرندگان یافت می شوند و بخشی از شیر، خون و غیره هستند. آنزیم ها، هورمون ها و ویروس ها نیز ماهیتی پروتئینی دارند.
ساختار پروتئین هاهمه پروتئین ها حاوی کربن، هیدروژن، اکسیژن، نیتروژن (به ندرت S، P، Fe) هستند.
وزن مولکولی پروتئین ها بسیار بزرگ است - از 5000 تا چندین میلیون.
دنباله ای که با آن باقی مانده های اسید آمینه α در زنجیره به هم متصل می شوند نامیده می شود ساختار اولیهسنجاب برای هر نوع پروتئین کاملاً منحصر به فرد است.
زنجیره پلی پپتیدی معمولاً به شکل مارپیچ است. تمایل یک زنجیره پلی پپتیدی به پیچیدن به یک مارپیچ توسط ساختار اولیه پروتئین تعیین می شود، اما قدرت آن با تشکیل پیوندهای هیدروژنی بین گروه ها تعیین می شود.  و –NH– پیچ های مجاور مارپیچ.
و –NH– پیچ های مجاور مارپیچ.
به عنوان مثال:

ویژگی پیچاندن زنجیره های پلی پپتیدی مولکول های پروتئین به یک مارپیچ نامیده می شود. ساختار ثانویهپروتئین ها
پیچ های مارپیچ به دلیل وجود پل های دی سولفیدی -S-S- می توانند به یک طریق خم شوند که این نقش را نیز می توان ایفا کرد پیوندهای هیدروژنی. در نتیجه این تا شدن بخش های مارپیچ، ظاهری از یک توپ ایجاد می شود. این شکل از ساختار پروتئین نامیده می شود ساختار سوم
در مولکول های برخی از پروتئین ها چندین "توپ" (گلبول) تشکیل می شود که در نتیجه آنها یک ساختار چهارتایی ظاهر می شود.پیوندهایی که زیرواحدهای پروتئین را به یک مولکول با ساختار چهارتایی متصل می کنند، کووالانسی نیستند، بلکه پیوندهای ضعیف تری هستند، مانند هیدروژن (مانند مولکول هموگلوبین)، برهمکنش های یونی یا به اصطلاح آبگریز. پروتئین هایی با ساختار چهارتایی به دلیل شکنندگی پیوندهای متصل کننده زیر واحدها، قابلیت تجزیه برگشت پذیر به زیر واحدها را دارند. در این حالت ممکن است فعالیت آنزیمی پروتئین ها از بین برود.
طبقه بندی پروتئین هاپروتئین ها به دو گروه اصلی تقسیم می شوند: پروتئین ها (پروتئین های ساده) و پروتئین ها (پروتئین های پیچیده). پروتئین ها فقط از اسیدهای آمینه تشکیل شده اند و پس از هیدرولیز محصولات دیگری را تشکیل نمی دهند. پروتئین ها از یک بخش پروتئینی ساخته شده از اسیدهای آمینه α و یک بخش غیر پروتئینی (گروه مصنوعی) تشکیل شده اند. در طول هیدرولیز، این پروتئین ها علاوه بر اسیدهای آمینه α، مواد دیگری را نیز تامین می کنند: کربوهیدرات ها، اسید فسفریک، ترکیبات هتروسیکلیک، رنگ ها و غیره.
به پروتئین ها به تعدادی پروتئین ساده اطلاق می شود که حلالیت های متفاوتی در حلال های مختلف دارند.
آلبومین –پروتئین هایی که در آب محلول هستند توسط محلول اشباع کلرید سدیم رسوب نمی کنند، بلکه توسط محلول اشباع سولفات آمونیوم رسوب می کنند و هنگامی که حرارت داده می شوند منعقد می شوند. نمایندگان: آلبومین های تخم مرغ، شیر، سرم خون، پروتئین های آنزیم ها و دانه های گیاهی.
گلوبولین ها -پروتئین های نامحلول در آب اما محلول در محلول های نمک رقیق. هنگام گرم شدن منعقد می شود. وزن مولکولی بالاتری نسبت به آلبومین دارند. نمایندگان: گلوبولین های شیر، تخم مرغ، خون، پروتئین ماهیچه ای (میوزین)، دانه های گیاهی.
پرولامین ها –پروتئین های محلول در الکل 70-80٪، نامحلول در آب و الکل بی آب. هنگام جوشیدن دلمه نمی شوند. نمایندگان: پروتئین های غلات (گلیادین - در گندم، زین - در ذرت).
گلوتلین –پروتئین های گیاهی، نامحلول در محلول های نمک خنثی و در اتیل الکل; فقط در محلول های قلیایی رقیق (0.2%) حل می شود. عمدتا در دانه های غلات موجود است. گلوتلین های موجود در برخی غلات را گلوتنین (از کلمه گلوتن) می نامند.
هیستون ها –پروتئین هایی با طبیعت پایه، زیرا حاوی مقدار قابل توجهی اسیدهای آمینه هستند که در آب و اسیدهای رقیق محلول هستند، اما در قلیاهای رقیق نامحلول هستند. معمولاً بخش های پروتئینی پروتئین های پیچیده را نشان می دهد. نمایندگان: گلوبین پروتئینی است که بخشی از هموگلوبین است.
پروتامین ها –ساده ترین پروتئین طبیعی با وزن مولکولی کم؛ آنها عمدتاً از اسیدهای آمینه تشکیل شده و بازهای قوی هستند. به خوبی در آب، اسیدهای رقیق و قلیایی حل می شود. هنگام گرم شدن منعقد نشود. نمایندگان پروتامین ها در اسپرم ماهی به عنوان بخشی از پروتئین های پیچیده - نوکلئوپروتئین ها یافت می شوند.
آلبومینوئیدها(اسکلروپروتئین ها) پروتئین هایی هستند که از نظر خواص به شدت با سایر پروتئین ها تفاوت دارند. آنها فقط با درمان طولانی مدت با اسیدهای غلیظ و قلیایی با شکافتن مولکول ها حل می شوند. در موجودات جانوری آنها عملکردهای حمایتی و پوششی را انجام می دهند، اما در گیاهان یافت نمی شوند. نمایندگان اسکلروپروتئین ها عبارتند از: فیبروئین - پروتئین ابریشم. کراتین - پروتئین مو، پشم، ماده شاخی، اپیدرم پوست؛ الاستین یک پروتئین در دیواره رگ های خونی و تاندون ها است. کلاژن یک ماده پروتئینی پوست، استخوان، غضروف و بافت همبند است.
پروتئین ها – پروتئین های پیچیده، بسته به ماهیت قسمت مصنوعی (غیر پروتئینی) به زیر گروه ها تقسیم می شوند.
فسفوپروتئین ها –پروتئین های حاوی باقی مانده اسید فسفریک به عنوان یک گروه مصنوعی. نمایندگان: کازئین - پروتئین شیر، ویتلین - پروتئینی که بخشی از زرده تخم مرغ است.
نوکلئوپروتئین ها –پروتئین هایی که خود قسمت پروتئینی با آنها مرتبط است اسیدهای نوکلئیکو دومی پس از هیدرولیز اسید فسفریک، ترکیبات هتروسیکلیک و کربوهیدرات ها را تشکیل می دهد. نوکلئوپروتئین ها بخشی از هسته سلول های گیاهی و جانوری هستند.
کروموپروتئین ها -موادی که در آن قسمت پروتئین با ماده رنگی ترکیب شده است. نماینده: هموگلوبین در خون در طول هیدرولیز تجزیه می شود و گلوبین پروتئین و ماده رنگی - هم را تشکیل می دهد.
گلوکوپروتئین ها –پروتئین هایی که در آن بخش پروتئین با یک کربوهیدرات ترکیب شده است. نماینده: موسین که بخشی از بزاق است.
لیپوپروتئین ها -اتصال پروتئین ها با لیپیدها؛ لیپوپروتئین ها در پروتوپلاسم سلول ها، سرم خون و زرده تخم مرغ یافت می شوند.
مواد پروتئینی نیز بر اساس شکل مولکول هایشان به دو گروه تقسیم می شوند:
الف) پروتئین های فیبریلار (فیبری) که مولکول های آنها شکل رشته ای دارند. اینها شامل فیبروئین ابریشم، کراتین پشم، میوزین عضلانی است.
ب) پروتئین های کروی که مولکول های آنها شکل گرد دارند. اینها شامل آلبومین ها، گلوبولین ها و تعدادی پروتئین پیچیده است.
ارزش غذایی پروتئین ها با ترکیب کمی و کیفی اسیدهای آمینه موجود در آنها تعیین می شود. پروتئین های کامل و ناقص وجود دارد.
پروتئین های کامل حاوی تمام اسیدهای آمینه ضروری (کازئین شیر، آلبومین تخم مرغ، پروتئین گوشت) هستند.
پروتئینهای ناقص آنهایی هستند که حداقل یکی از اسیدهای آمینه ضروری (زئین ذرت، ژلاتین) را ندارند.
خواص پروتئین هامواد پروتئینی از نظر حالت تجمع متفاوت هستند. اغلب اینها مواد جامد آمورف هستند که شبیه پودرهای سفید هستند. پروتئین های پشم (کراتین) و ابریشم (فیبروئین) الیاف قوی هستند. برخی از پروتئین ها در حالت کریستالی (هموگلوبین خون) به دست می آیند، بسیاری از آنها قوام مایعات چسبناک یا ژله ای دارند.
همه پروتئین ها در الکل بی آب و سایر حلال های آلی نامحلول هستند. بسیاری از پروتئین ها در آب و محلول های نمک رقیق حل می شوند، اما به جای محلول های واقعی، محلول های کلوئیدی تشکیل می دهند. پروتئین هایی وجود دارند که کاملاً در آب نامحلول هستند.
محلول های پروتئین های طبیعی از نظر نوری فعال هستند (عمدتا دارای چرخش چپ هستند).
پروتئین ها مانند اسیدهای آمینه آمفوتریک هستند و با اسیدها و بازها نمک تشکیل می دهند:
H 3 N + –R–COO – + H + + Cl –  NH 3 + –R–COOH + Сl – ;
NH 3 + –R–COOH + Сl – ;
H 3 N + –R–COO – + Na + + OH –  NH 2 –R–COO – + Na + + H 2 O.
NH 2 –R–COO – + Na + + H 2 O.
در حضور اسیدها، مولکول های پروتئین حامل بار مثبت هستند و در حین الکترولیز به سمت کاتد حرکت می کنند، مولکول های پروتئین بار منفی را حمل می کنند و به سمت آند حرکت می کنند. در یک مقدار pH مشخص، محلول حاوی حداقل مقدار کاتیون ها و آنیون های پروتئینی خواهد بود. در این شرایط، حرکت مولکول های پروتئین در طول الکتروفورز رخ نمی دهد. مقدار pH محلولی که محلول پروتئین حاوی حداقل مقدار کاتیون و آنیون است نامیده می شود نقطه ایزوالکتریکبرای پروتئین های مختلف، مقدار نقطه ایزوالکتریک یکسان نیست. به عنوان مثال، برای سفیده تخم مرغ (آلبومین) نقطه ایزوالکتریک در pH = 4.8، برای پروتئین گندم (گلیادین) - در pH = 9.8 است.
همه پروتئین ها دارای برخی ویژگی های مشترک هستند: واکنش های رسوب از محلول ها و واکنش های رنگی.
رسوب پروتئین ها از محلول ها.وقتی به محلول های آبیپروتئین ها از محلول های غلیظ نمک های معدنی (به عنوان مثال، (NH 4) 2 SO 4)، پروتئین ها رسوب می کنند، الکل و استون تأثیر مشابهی بر پروتئین ها دارند. در تمام این موارد، پروتئین ها خواص خود را تغییر نمی دهند و هنگامی که با آب رقیق می شوند، به محلول برمی گردند. این فرآیند نامیده می شود نمک زدن
هنگامی که گرم می شود، بسیاری از پروتئین ها منعقد می شوند (به عنوان مثال، سفیده تخم مرغ) و همچنین از محلول ها رسوب می کنند، اما توانایی خود را برای حل شدن در آب از دست می دهند. در این حالت، تغییر قابل توجهی در خواص پروتئین ها رخ می دهد. این فرآیند رسوب غیر قابل برگشت پروتئین نامیده می شود دناتوره سازیدناتوره شدن می تواند توسط نمک های فلزات سنگین (CuSO 4، Pb (CH 3 COO) 2، HgCl، و غیره)، اسیدهای غلیظ (HNO 3، H 2 SO 4، CH 3 COOH، پیکریک، کلرواستیک)، قلیاهای سوزاننده ایجاد شود. KOH، NaOH)، فنل، فرمالین، تانن و غیره.
دناتوره شدن پروتئین نیز در اثر انواع پرتوها (اشعه فرابنفش، رادیواکتیو و غیره) ایجاد می شود. در طی دناتوره سازی، ساختارهای چهارم، سوم و ثانویه از بین می روند. ساختار اولیه معمولاً حفظ می شود ، یعنی از بین رفتن پیوندهای پپتیدی رخ نمی دهد. ساختار اولیه پروتئین در طول هیدرولیز پروتئین که در طول هضم غذاهای پروتئینی رخ می دهد از بین می رود. در دستگاه گوارش، تحت تأثیر آنزیم ها، پروتئین های غذا از طریق یک سری محصولات میانی به اسیدهای آمینه تجزیه می شوند. از ترکیب آمینو اسیدهای به دست آمده، بدن پروتئین های مورد نیاز خود را ایجاد می کند. باقی مانده های پروتئینی استفاده نشده به ترکیبات ساده تری تجزیه شده و از بدن دفع می شوند.
واکنش های رنگی پروتئین ها
1. واکنش بیورت.
هنگام تعامل با نمک های مس (CuSO 4) در یک محیط قلیایی، همه پروتئین ها رنگ بنفش می دهند. این واکنش کیفی است پیوندهای پپتیدیو وجود آنها را در پروتئین ها و پلی پپتیدها تایید می کند. برای پلی پپتیدهای مختلف، رنگی که هنگام تعامل با نمک های مس ظاهر می شود یکسان نیست: دی پپتیدها رنگ آبی، تری پپتیدها رنگ بنفش و پلی پپتیدهای پیچیده تر رنگ قرمز می دهند.
2. واکنش زانتوپروتئین.
هنگامی که محلول های پروتئینی با اسید نیتریک غلیظ (HNO 3) گرم می شوند، زرد می شوند. این واکنش با حضور در پروتئین های اسیدهای آمینه حاوی رادیکال های هیدروکربنی معطر (C6H5-) توضیح داده می شود که در هنگام تعامل با اسید نیتریکترکیبات نیترو را به رنگ زرد تشکیل می دهند.
3. واکنش سیستین (سولفیدریل).
اگر محلول پروتئینی را با مقدار زیادی هیدروکسید سدیم بجوشانید و چند قطره محلول استات سرب Pb(CH 3 COO) 2 اضافه کنید، رنگ یا رسوب قهوه ای مایل به سیاه ظاهر می شود.
پروتئین + NaOH  Na 2 S+ مواد دیگر.
Na 2 S+ مواد دیگر.
Na 2 S + Pb (CH 3 COO) 2 → PbS↓ + 2CH 3 COONa.
این واکنش وجود گوگرد با پیوند ضعیف در پروتئین ها را تأیید می کند.
تعدادی واکنش کیفی دیگر به پروتئین وجود دارد.
معنی و کاربرد پروتئین هاپروتئین ها مهمترین جزء محصولات غذایی هستند. بیش از 50 درصد پروتئین های موجود در رژیم غذایی انسان باید پروتئین حیوانی باشد. یک فرد بالغ به 80-100 گرم پروتئین در روز نیاز دارد و با فعالیت بدنی سنگین - 120 گرم یا بیشتر.
مواد پروتئینی به طور گسترده در تولید کالاهای صنعتی (چرم، پشم، خز، ابریشم)، در تولید چسب، ژلاتین، پلاستیک (گاالیت)، پشم مصنوعی، برای تهیه امولسیون های حساس به نور در صنعت عکس و غیره استفاده می شود.
بسیاری داروهاماهیتی پروتئینی دارند (انسولین، پانکراتین و غیره). توجه ویژه باید به کاتالیزورهای بیولوژیکی - آنزیم ها، که همچنین مواد پروتئینی هستند، شود. آنها اغلب فقط در مقادیر بسیار اندک وجود دارند، آنها به تبدیل شیمیایی سریع مقادیر زیادی از مواد مختلف در شرایط بسیار ملایم (دمای پایین و غیره) کمک می کنند.
ویروس ها و باکتری ها نیز ماهیتی پروتئینی دارند. بنابراین، هنگام نگهداری محصولات غذایی و درمان بیماریهای مختلف، از داروهایی استفاده میشود که مواد پروتئینی (اسید سالیسیلیک، آسپرین، سالول، تانن، پلیفنولهای مختلف، اسید استیک و غیره) را تغییر میدهند.
پروتئین ها موادی هستند که برای زندگی حیوانات، گیاهان و میکروارگانیسم ها کاملا ضروری هستند. زندگی خود فرآیند تبدیل پیچیده مواد پروتئینی است.
گلیسین (اسید آمینه استیک، گلیکوکول، Gly، G)
H2NCH2COOH
وزن مولکولی 75.07; کریستال های بی رنگ؛ ذوب شدن 232-236 درجه سانتیگراد (با تجزیه). بسیار محلول در آب، نامحلول در اکثر حلال های آلی. در 25 درجه سانتی گراد p K a 2.34 (COOH) و 9.6 (NH 2)؛ r من 5,97.
از نظر خواص شیمیایی، گلیسین یک اسیدآمینه آلیفاتیک معمولی است. تعیین کمی بر اساس تشکیل محصولات رنگی با o-phthalaldehyde (واکنش Zimmermann) است. بیشتر از سایر اسیدهای آمینه در پروتئین ها یافت می شود. به عنوان پیش ساز در بیوسنتز ترکیبات پورفیرین و بازهای پورینی عمل می کند. گلیسین یک اسید آمینه رمزگذاری شده، غیر ضروری است. بیوسنتز آن با ترانس آمیناسیون اسید گلیوکسیلیک، برش آنزیمی سرین و ترئونین انجام می شود. لیسین از اسید کلرواستیک و NH 3 سنتز می شود. در طیف NMR در D 2 O، شیفت شیمیایی پروتون های گروه CH 2 3.55 ppm است. نمک داخلی گلیسین (CH 3) 3 + NCH 2 COO بتائین نامیده می شود.
گلیسین برای سنتز پپتیدها، به عنوان جزئی از محلول های بافر، در مخلوط با سایر اسیدهای آمینه - برای تغذیه تزریقی استفاده می شود.
کروماتوگرام نمونه های حاوی این ماده
آمینو اسیدها ترکیبات آمفوتریک آلی هستند. آنها حاوی دو گروه عملکردی با طبیعت مخالف در مولکول هستند: یک گروه آمینه با خواص پایه و یک گروه کربوکسیل با خواص اسیدی. اسیدهای آمینه هم با اسیدها و هم با بازها واکنش می دهند:
H 2 N -CH 2 -COOH + HCl → Cl [H 3 N-CH 2 -COOH]،
H 2 N -CH 2 -COOH + NaOH → H 2 N - CH 2 -COONa + H 2 O.
هنگامی که اسیدهای آمینه در آب حل می شوند، گروه کربوکسیل یک یون هیدروژن را حذف می کند که می تواند به گروه آمینه بچسبد. در این حالت یک نمک داخلی تشکیل می شود که مولکول آن یک یون دوقطبی است:
H 2 N-CH 2 -COOH + H 3 N -CH 2 -COO - .
تبدیل اسید-باز اسیدهای آمینه به محیط های مختلفرا می توان با نمودار کلی زیر نشان داد:

محلول های آبی اسیدهای آمینه بسته به تعداد گروه های عاملی دارای محیط خنثی، قلیایی یا اسیدی هستند. بنابراین، اسید گلوتامیک یک محلول اسیدی (دو گروه -COOH، یک -NH 2) تشکیل می دهد، لیزین یک محلول قلیایی (یک گروه -COOH، دو -NH2) تشکیل می دهد.
مانند آمین های اولیه، اسیدهای آمینه با اسید نیتروژن واکنش می دهند و گروه آمینه به یک گروه هیدروکسو و اسید آمینه به یک اسید هیدروکسی تبدیل می شود:
H2N-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2 + H2O
اندازه گیری حجم نیتروژن آزاد شده به ما امکان می دهد مقدار اسید آمینه را تعیین کنیم ( روش ون اسلایک).
اسیدهای آمینه می توانند در حضور گاز هیدروژن کلرید با الکل ها واکنش داده و به آن تبدیل شوند استر(به طور دقیق تر، به نمک هیدروکلراید اتر):
H 2 N-CH(R)-COOH + R’OH H 2 N-CH(R)-COOR’ + H 2 O.
استرهای اسید آمینه ساختار دوقطبی ندارند و ترکیبات فرار هستند.
مهمترین خاصیت اسیدهای آمینه توانایی آنها در متراکم شدن و تشکیل پپتیدها است.
واکنش های کیفی.
1) تمام اسیدهای آمینه توسط نین هیدرین اکسید می شوند

با تشکیل محصولات رنگ شده در رنگ آبی بنفش. پرولین اسید ایمینو با نین هیدرین رنگ زرد می دهد. از این واکنش می توان برای تعیین کمیت اسیدهای آمینه توسط اسپکتروفتومتری استفاده کرد.
2) هنگامی که آمینو اسیدهای معطر با اسید نیتریک غلیظ گرم می شوند، نیتراسیون حلقه بنزن رخ می دهد و ترکیبات در آن رنگ می شوند. زرد. این واکنش نامیده می شود زانتوپروتئین(از یونانی xanthos - زرد).
پروتئین ها پلی پپتیدهایی با وزن مولکولی نسبتاً بزرگ هستند که ساختار فضایی خاصی دارند که به دنباله اسیدهای آمینه موجود در زنجیره پروتئین بستگی دارد. این ساختار می تواند فشرده (پروتئین های کروی) یا دراز (پروتئین های فیبریلار) باشد. همه آنزیم ها پروتئین های کروی هستند، پروتئین های فیبریلار شامل کلاژن، کراتین - پروتئین های پوست و مو، بسیار قوی و بسیار قابل انبساط هستند.
بر اساس ترکیب آنها، پروتئین ها به ساده ای تقسیم می شوند که فقط از اسیدهای آمینه تشکیل شده است و پروتئین های پیچیده - مجتمع ها یا ترکیبات کووالانسیپلی پپتیدها با مولکول های کلاس های دیگر:
اسیدهای نوکلئیک - نوکلئوپروتئین ها؛
پلی ساکاریدها - گلیکوپروتئین ها؛
لیپیدها - لیپوپروتئین ها؛
رنگدانه ها - کروموپروتئین ها؛
باقی مانده های اسید فسفریک - فسفوپروتئین ها.
بخش پروتئینی یک پروتئین پیچیده نامیده می شود apobelcomغیر پروتئینی – گروه پروتز. تقریباً تمام پروتئین های کروی ساده و پیچیده آنزیم هستند - کاتالیزورهای بیولوژیکی واکنش های بیوشیمیایی در موجودات زنده.
وظایف
وظیفه 1.در طی واکنش با چه حجمی از گاز (در شرایط عادی) آزاد می شود اسید نیتروژن 0.001 مول اسید آمینه: الف) لوسین. ب) لیزین؛ ج) پرولین؟
راه حل
اجازه دهید معادلات واکنش اسیدهای آمینه ذکر شده با اسید نیتروژن را بنویسیم.
در مورد لوسین و لیزین، دآمیناسیون طبق ون اسلایک و برای لیزین در دو گروه آمینه موجود در مولکول رخ می دهد. پرولین یک گروه آمینه اولیه ندارد، بنابراین فرآیند در مرحله N-nitrosation متوقف می شود. در واکنش (a)، تعداد مول های لوسین n(Leu) برابر با تعداد مول های نیتروژن آزاد شده n(N2) است، بنابراین 0.001 مول یا 22.4 میلی لیتر نیتروژن آزاد می شود. در واکنش (ب)
مقدار دو برابر گاز 2n (N 2) در مقایسه با n (lys) تشکیل می شود، زیرا اسید آمینه اصلی دارای دو گروه آمینه اولیه است. حجم نیتروژن آزاد شده 44.8 میلی لیتر خواهد بود. در واکنش (c)، نیتروژن آزاد نمی شود: پرولین تنها یکی از 20 اسید آمینه ضروری است که یک اتم نیتروژن ثانویه در موقعیت a دارد. هنگامی که نیتروزه می شود، یک ترکیب N-nitroso (به جای دیازو) تشکیل می شود.پاسخ:
الف) 22.4 میلی لیتر N 2؛ب) 44.8 میلی لیتر N 2; ج) انتشار N 2 وجود ندارد. وظیفه 2.در نتیجه درمان محلولی حاوی 9.36 میلی گرم اسید آمینه ناشناخته با اسید نیتروژن اضافی در 748 میلی متر جیوه. و در دمای 20 درجه سانتی گراد، 01/2 میلی لیتر نیتروژن به دست آمد.
راه حل
حداقل چیست

جرم مولی این اسید آمینه؟واکنش اسید آمینه با اسید نیتروژن: با استفاده از ترکیب، بیایید حجم نیتروژن را در شرایط عادی (در دمای 0 درجه سانتیگراد یا 273 درجه کلوین و فشار 760 میلی متر جیوه) محاسبه کنیم: V 0 (N 2) (n.s.) = (P 1 · V 1 · T 0)/(P 0 ·T 1) = (748·2.01·273)/(760·293) = 1.84 میلی لیتر.
از آنجایی که تعداد مول های ماده اسید آمینه و گاز تکامل یافته N2 یکسان است، نسبت را ایجاد می کنیم:
9.36 میلی گرم اسید آمینه 1.84 میلی لیتر N 2 می دهد.
M (وزن مولکولی اسید آمینه) = 22.4 N 2 خواهد داد.
M = (9.36·22.4)/1.84 = 114.
این می تواند والین باشد: 
وظیفه 3.هموگلوبین حیوانی حاوی 0.335 درصد آهن (از نظر وزن) است. حداقل جرم مولی این پروتئین چقدر است؟ اگر وزن مولکولی پروتئین با اندازه گیری فشار اسمزی 67000 باشد، چند اتم آهن در مولکول وجود دارد؟
راه حل
کسر جرمیآهن در هموگلوبین: C%(Fe) = /M(پروتئین)، که در آن n تعداد اتم های آهن در مولکول پروتئین است. اجازه دهید n = 1، سپس M(پروتئین)1 = M(Fe) 100%/C%(Fe) = 56 100/0.335 = 16700. از آنجایی که مقدار واقعی (بر اساس شرط) منبع M(پروتئین). = 67000، n = M منبع/M 1 = 67000/16700 = 4.
وظیفه 4.در طی هیدرولیز قلیایی 48 گرم دی پپتید متشکل از بقایای همان اسید آمینه، تنها یک ماده تشکیل شد - نمک سدیم اسید آمینه. جرم این نمک 66.6 گرم است.
راه حل
معادله واکنش برای هیدرولیز قلیایی یک دی پپتید به صورت زیر است:
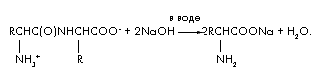
اجازه دهید مقدار دی پپتید را در مول (دی پپتید) = x نشان دهیم. سپس واکنش هیدرولیز دو برابر مقدار قلیایی (NaOH) = 2x مصرف می کند و (اسیدهای آمینه) = 2x و (H2O) = x تولید می کند. بیایید یک معادله بسازیم تعادل موادبا استفاده از فرمول m = ·M;
m(دی پپتید) + m(NaOH) = m(نمک های اسید آمینه) + m(H2O). 48 + 2x 40 = 66.6 + x 18; 62x = 18.6; ![]() .
.
x = 0.3 مول. M(دی پپتید) = m/ = 48/0.3 = 160. M(اسیدهای آمینه) = [M(دی پپتید) + M(H2O)]/2 = 178/2 = 89 گرم بر مول.
-
اسید آمینه آن آلانین است. ساختار دی پپتیدی:
مقالات مرتبط
-
درک معلمان از تجربیات دانش آموزان دبیرستانی فناوری روانشناختی و آموزشی گفتگوی اخلاقی به عنوان ابزاری برای ایجاد درک متقابل بین دانش آموزان دبیرستانی و معلمان
"حمله مغول به روسیه" - دلایل شکست نیروهای روسی. مغول ها چنگیز خان (1206-1227). حمله تاتار و مغول. در 1241-1242 تاتارهای مغول لهستان، جمهوری چک و مجارستان را ویران کردند. اولین لشکرکشی باتو در شمال شرقی روسیه...
-
ارائه با موضوع "شخصیت" ارائه با موضوع شخصیت انسان
برای استفاده از پیش نمایش ارائه، یک حساب Google ایجاد کنید و وارد آن شوید: https://accounts.google.com شرح اسلاید: شخصیت و خلق و خو. اجرا شده توسط معلم ایمنی زندگی MCOU "مدرسه متوسطه ناریشکینسکایا"...
-
اکتشافات در پایین ترانشه ماریانا
گسل های عمیقی در پوسته زمین وجود دارد - فرورفتگی های دریایی در پایین اقیانوس ها، جایی که تاریکی غیر قابل نفوذ و بالاترین فشار حاکم است. ما مجموعه ای از عمیق ترین فرورفتگی های دریایی را ارائه می دهیم که عدم وجود...
-
ناپلئون بناپارت - جنگ ها
این جنگ در درجه اول به دلیل امتناع روسیه از حمایت فعالانه از محاصره قاره ای بود که ناپلئون آن را سلاح اصلی در مبارزه با بریتانیای کبیر می دانست. علاوه بر این بناپارت سیاستی را در ...
-
فرمول های اساسی در فیزیک - الکتریسیته و مغناطیس
تعاملات. برهمکنش مغناطیسی بین آهن و آهنربا یا بین آهنرباها نه تنها زمانی که آنها در تماس مستقیم هستند، بلکه در فاصله دور نیز رخ می دهد. با افزایش فاصله، نیروی برهمکنش کاهش می یابد و...







