Тархалт ба бөөмийн туршлагын элемент. Атомын физик. Рутерфордын альфа бөөмийн тархалтын туршилт. Рутерфордын туршилтууд: атомын цөмийн загвар
11-р ангийн физикийн хичээл
Сэдэв:
"Рутерфордын Альфа бөөмсийг тараах туршилт"
Хичээлийн зорилго, зорилтууд:
Боловсролын:
Рутерфордын туршилтын механизмыг тайлбарла
Боловсролын:
сурагчдын танин мэдэхүйн бие даасан байдлыг хөгжүүлэх;
ёс суртахууны болон гоо зүйн боловсролд хувь нэмэр оруулах.
Боловсролын:
Гол, чухал зүйлийг тодруулах, судалж буй баримтуудыг харьцуулах, бодлоо логикоор илэрхийлэх чадварыг хөгжүүлэх.
Хичээлийн явц:
I.Org. мөч.
Ширээнийхээ дэргэд шууд зогсоод биеэ цэвэрлэ. Багшдаа сайн уу гэж хэлээрэй. Дараа нь суудалдаа чимээгүйхэн суугаад ангидаа эмх цэгцтэй бай.
Хичээлийн сэдэв, зорилгыг тодорхойлох.
II. Давталт
Шугамын спектрүүд
1. Атом гэдэг үг ямар утгатай вэ?2.Химийн элементүүдийн шинж чанаруудын үе үе давтагдах хуулийг аль эрдэмтэн нээсэн бэ?
3. Атом хуваагдашгүй юу?
4.Ховоржуулсан хийг халах үед юу болдог өндөр температур?
5.Харанхуй зайгаар тусгаарлагдсан олон өнгийн зураасыг юу гэж нэрлэдэг вэ?
6. Хий болгонд юу байдаг вэ?
7. Аль хий хамгийн энгийн спектртэй вэ?
8.Ямар хийн спектр 4 шугамаас бүрдэх вэ?
9.Үзэгдэх бүсийн спектрийн шугамын томъёог ямар эрдэмтэн сонгосон бэ?
10. Үзэгдэх, хэт ягаан туяа, хэт улаан туяаны мужуудын томьёог нэг ерөнхий томьёо болгон нэгтгэх боломжийг хэний онол хийсэн бэ?
Физминуткавидеоны дагуу.
III. Шинэ материал
§ 7.2. Рутерфордын альфа бөөмийн тархалтын туршилт.
Альфа тоосонцор алтан тугалган цаасаар дамжин өнгөрч буй тархалтыг судалснаар,ЭрнестРутерфорд атомын бүх эерэг цэнэг нь тэдний төвд маш том, нягт цөмд төвлөрдөг гэсэн дүгнэлтэд хүрсэн. Мөн сөрөг цэнэгтэй бөөмс (электронууд) энэ цөмийг тойрон эргэлддэг.

Энэ загвар нь тухайн үед өргөн тархсан атомын Томсоны загвараас үндсээрээ ялгаатай байв.

Жозеф ЖонТомсон атомын загварыг пудинг (бялуу) хэлбэрээр санал болгосон бөгөөд эерэг цэнэг нь атомын бүх эзэлхүүнийг жигд дүүргэж, электронууд нь хоорондоо огтлолцсон байв.

Хэсэг хугацааны дараа Рутерфордын загварыг атомын гаригийн загвар гэж нэрлэсэн (энэ нь үнэхээр төстэй юм нарны систем: хүнд цөм нь Нар, түүнийг тойрон эргэлдэх электронууд нь гаригууд юм).
1912 онд Э.Рутерфорд болон түүний хамтрагчид альфа бөөмсийг матерт тараах туршилт хийжээ.

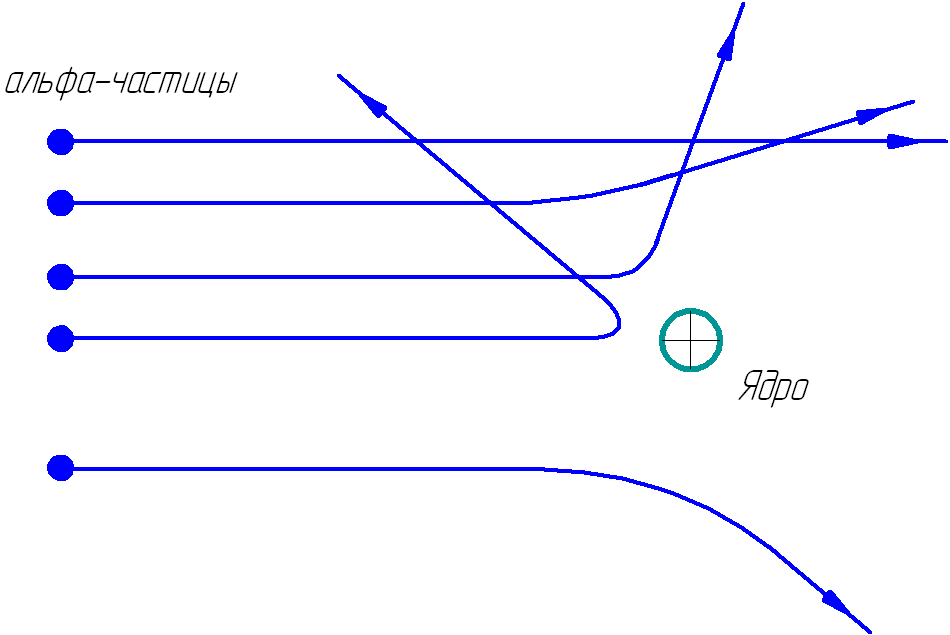
Рутерфордын туршилтын схем.
Тугалган цаас байхгүй үед альфа бөөмсийн нимгэн цацрагаас үүссэн гялалзахаас бүрдсэн тод тойрог дэлгэцэн дээр гарч ирэв. Гэхдээ альфа бөөмсийн замд ойролцоогоор 0.1 мкм (микрон) зузаантай нимгэн алтан тугалган цаасыг байрлуулахад дэлгэцэн дээр ажиглагдсан зураг ихээхэн өөрчлөгдсөн: бие даасан анивчих нь өмнөх тойргийн гадна гарч ирсэн төдийгүй тэдгээр нь бүр байж болно. алтны тугалган цаасны эсрэг талаас ажиглагдсан.
Дэлгэцийн өөр өөр газар нэгж хугацаанд ногдох гялбааны тоог тоолох замаар орон зайд тархсан альфа бөөмсийн тархалтыг тогтоох боломжтой. Альфа бөөмсийн тоо тархалтын өнцөг ихсэх тусам хурдан буурдаг.
Дэлгэц дээр ажиглагдсан зураг нь альфа тоосонцоруудын дийлэнх нь хөдөлгөөний чиглэлд мэдэгдэхүйц өөрчлөлтгүйгээр алтны цаасаар дамжин өнгөрдөг гэсэн дүгнэлтэд хүргэсэн. Гэсэн хэдий ч зарим бөөмс альфа бөөмсийн анхны чиглэлээс том өнцгөөр хазайсан (ойролцоогоор 135). o...150 o ) бүр буцааж хаясан. Альфа тоосонцор тугалган цаасаар дамжин өнгөрөхөд 10,000 бөөмс тутамд зөвхөн нэг нь 10-аас дээш өнцгөөр хазайдаг болохыг судалгаагаар тогтоожээ.О хөдөлгөөний анхны чиглэлээс. Зөвхөн ховор тохиолдлын хувьд альфа бөөмсийн аль нэг нь анхны чиглэлээсээ хазайдаг.
Олон тооны альфа тоосонцор хөдөлгөөний чиглэлээсээ хазайлгүй тугалган цаасаар дамжсан нь атом нь хатуу биет биш гэдгийг харуулж байна. Альфа бөөмийн масс нь электроны массаас бараг 8000 дахин их байдаг тул тугалган цаасны атомуудад орсон электронууд альфа бөөмсийг мэдэгдэхүйц өөрчилж чадахгүй. Альфа бөөмсийн тархалт нь атомын эерэг цэнэгтэй бөөмс болох атомын цөмөөс үүдэлтэй байж болно.
IV.Арматур
Жишээнүүдийг авч үзэх.
В. Тусгал
Өнөөдрийн хичээл танд таалагдсан уу?.. Юу санаж байна вэ?..
VI. D/Z §7.1-ийг давтаж, §7.2-ыг сур
Атомын бүтэцнарийн төвөгтэй юм. Үүнийг электрон, рентген туяа, цацраг идэвхит бодис зэрэг үзэгдлийн нээлтүүд баталж байна. Онолын судалгаа, олон тооны туршилтын үр дүнд А атомын бүтцийн онол. Английн физикч Эрнест атомын бүтцийн онолыг бий болгоход онцгой чухал хувь нэмэр оруулсан. Рутерфорд(1871 - 1937), алт, цагаан алтны нимгэн металл хавтангаар альфа тоосонцор дамжин өнгөрөх туршилтыг хийсэн.
Рутерфорд 1906 онд уран эсвэл радийн цөмөөс ялгардаг 4.05 МэВ энергитэй альфа бөөмс бүхий хүнд элементийн атомуудыг шинжлэхийг санал болгов. Тиймээс матер дахь альфа бөөмсийн тархалтыг (хөдөлгөөний чиглэлийн өөрчлөлт) судлахыг санал болгов.
Альфа бөөмийн масс нь электроны массаас 8000 дахин их байдаг. Эерэг цэнэг нь электрон 2e цэнэгээс хоёр дахин их хэмжээтэй тэнцүү байна. Альфа бөөмийн хурд нь гэрлийн хурдны 1/15 буюу 2 * 10 7 м/с байна. Альфа бөөмснь бүрэн ионжсон гелийн атом юм.
Рутерфордын туршилтын хялбаршуулсан диаграммыг Зураг дээр үзүүлэв. 1.1. Нарийн сувагтай 3-р суваг бүхий хар тугалгатай цилиндр 2-ын дотор байрлуулсан цацраг идэвхт эх үүсвэрээс альфа бөөмс ялгарсан.Сувгаас гарсан альфа бөөмсийн нарийхан цацраг тугалган цаасны гадаргуутай перпендикуляр судлагдсан материалаар хийсэн тугалган цаас 4 дээр унасан. Хар тугалганы цилиндрээс альфа тоосонцор зөвхөн сувгаар дамжиж, үлдсэн хэсэг нь хар тугалгад шингэсэн байна. Тугалган цаасаар дамжин тархсан альфа тоосонцор нь гэрэлтдэг бодис (цайрын сульфат) -аар бүрсэн тунгалаг дэлгэц 5 дээр унав. Энэ бодис нь альфа бөөмийг цохиход гэрэлтэх чадвартай байв. Бөөм бүр дэлгэцтэй мөргөлдөхөд гэрлийн гялбаа дагалдав. Үүнийг флэш гэж нэрлэдэг гялалзах(Латин сцинтилляциас - гялалзсан, богино хугацааны гэрлийн гялбаа). Дэлгэцийн ард микроскоп байсан 6. Альфа тоосонцорыг агаарт нэмж тараахаас сэргийлэхийн тулд төхөөрөмжийг бүхэлд нь хангалттай вакуумтай саванд хийсэн.
Цагаан будаа. 1.1. Рутерфордын туршилтуудын хялбаршуулсан схем.
Тугалган цаас байхгүй үед альфа бөөмсийн нимгэн цацрагаас үүссэн гялалзахаас бүрдсэн тод тойрог дэлгэцэн дээр гарч ирэв. Гэхдээ альфа бөөмсийн замд ойролцоогоор 0.1 мкм (микрон) зузаантай нимгэн алтан тугалган цаасыг байрлуулахад дэлгэцэн дээр ажиглагдсан зураг ихээхэн өөрчлөгдсөн: бие даасан анивчих нь өмнөх тойргийн гадна гарч ирсэн төдийгүй тэдгээр нь бүр байж болно. алтны тугалган цаасны эсрэг талаас ажиглагдсан.
Дэлгэцийн өөр өөр газар нэгж хугацаанд ногдох гялбааны тоог тоолох замаар орон зайд тархсан альфа бөөмсийн тархалтыг тогтоох боломжтой. Альфа бөөмсийн тоо тархалтын өнцөг ихсэх тусам хурдан буурдаг.
Дэлгэц дээр ажиглагдсан зураг нь альфа тоосонцоруудын дийлэнх нь хөдөлгөөний чиглэлд мэдэгдэхүйц өөрчлөлтгүйгээр алтны цаасаар дамжин өнгөрдөг гэсэн дүгнэлтэд хүргэсэн. Гэсэн хэдий ч зарим бөөмс нь альфа бөөмсийн анхны чиглэлээс том өнцгөөр хазайж (ойролцоогоор 135 o ... 150 o) бүр буцаж шидэгдсэн байна. Альфа тоосонцор тугалган цаасаар дамжин өнгөрөхөд 10,000 унасан тоосонцор тутамд зөвхөн нэг нь хөдөлгөөний анхны чиглэлээс 10°-аас дээш өнцгөөр хазайдаг болохыг судалгаагаар тогтоожээ. Зөвхөн ховор тохиолдлын хувьд альфа бөөмсийн аль нэг нь анхны чиглэлээсээ хазайдаг.
Олон тооны альфа тоосонцор хөдөлгөөний чиглэлээсээ хазайлгүй тугалган цаасаар дамжсан нь атом нь тасралтгүй тогтоц биш гэдгийг харуулж байна. Альфа бөөмийн масс нь электроны массаас бараг 8000 дахин их байдаг тул тугалган цаасны атомуудын нэг хэсэг болох электронууд альфа бөөмсийн замналыг мэдэгдэхүйц өөрчилж чадахгүй. Альфа бөөмсийн тархалт нь атомын эерэг цэнэгтэй бөөмс болох атомын цөмөөс үүдэлтэй байж болно.
Атомын цөм- энэ бол атомын бараг бүх масс, бараг бүх эерэг цэнэг төвлөрсөн жижиг бие юм.
Альфа бөөмс цөмд ойртох тусам цахилгаан харилцан үйлчлэлийн хүч ихсэж, бөөмийн хазайсан өнцөг их байх болно. Цөмөөс богино зайд эерэг цэнэгтэй альфа бөөмс нь цөмөөс ихээхэн түлхэх F хүчийг мэдэрдэг бөгөөд энэ нь Кулоны хуулиар тодорхойлогддог.
| F= |
энд r нь цөмөөс альфа бөөмс хүртэлх зай;
ε 0 – SI нэгж дэх цахилгаан тогтмол;
p - цөм дэх протоны тоо; e = 1.6*10-19 C – энгийн цахилгаан цэнэгийн үнэмлэхүй утга (электрон цэнэг); 2e – альфа бөөмийн цэнэг Зураг 1.2-т цөмөөс янз бүрийн зайд нисч буй альфа бөөмсийн траекторийг харуулав.Рутерфорд тодорхой өнцгөөр тархсан альфа бөөмсийн тоог атомын цөм дэх альфа бөөмс ба протон p-ийн энергитэй холбосон томьёог нэвтрүүлж чадсан. Томъёоны туршилтын баталгаажуулалт нь түүний үнэн зөвийг баталж, цөм дэх протоны тоо нь атомын доторх электронуудын тоо Z-тэй тэнцүү бөгөөд атомын дугаараар тодорхойлогддог болохыг харуулсан.
химийн элемент
(өөрөөр хэлбэл элементийн серийн дугаар
Янз бүрийн өнцгөөр тархсан альфа бөөмсийн тоог тоолсноор Рутерфорд цөмийн шугаман хэмжээсийг тооцоолж чадсан. Эерэг цөм альфа бөөмийг буцааж шидэхийн тулд атомын цөмийн хил дээрх электростатик (кулон) түлхэлтийн потенциал энерги нь альфа бөөмийн кинетик энергитэй тэнцүү байх ёстой.
| = |
Цөм нь диаметртэй болох нь тогтоогдсон.
D i = 10 -13 ...10 -12 см = 10 -15 ...10 -14 м
Атомын шугаман диаметр:
D a = 10 -8 см = 10 -10 м
Атомын гаригийн загвар
Олон тооны туршилтуудад дүн шинжилгээ хийсний дараа Рутерфорд 1911 онд санал болгов гаригийн атомын загвар (цөмийн загваратом).
Энэ загварын дагуу атомын төв хэсэгт атомын бараг бүх масс төвлөрсөн эерэг цэнэгтэй цөм байдаг. Сөрөг цэнэгтэй электронууд цөмийн эргэн тойронд эргэлддэг. Нарыг тойрон эргэлддэг гаригуудтай адил электронууд цөмийг тойрон харьцангуй хол зайд хөдөлдөг. Эдгээр электронуудын цуглуулгаас үүсдэг электрон бүрхүүл эсвэл электрон үүл.
Атом нь бүхэлдээ төвийг сахисан тул электронуудын нийт сөрөг цэнэгийн үнэмлэхүй утга нь цөмийн эерэг цэнэгтэй тэнцүү байна: цөм дэх протоны Z*e тоо нь электронуудын тоотой тэнцүү байна. электрон үүлД.И.Менделеевийн үечилсэн систем дэх өгөгдсөн химийн элементийн атомын серийн дугаар (атомын дугаар) Z-тэй давхцаж байна.
Жишээлбэл, устөрөгчийн атом нь Z = 1 атомын дугаартай тул устөрөгчийн атом нь электрон цэнэгийн үнэмлэхүй утгатай тэнцүү цэнэгтэй эерэг цөмөөс бүрдэнэ. Нэг электрон цөмийг тойрон эргэдэг. Устөрөгчийн атомын цөмийг протон гэж нэрлэдэг. Литийн атом нь Z = 3 атомын дугаартай тул литийн атомын цөмийг тойрон 3 электрон эргэлддэг.
Компьютерийн программ нь Рутерфордын атомыг альфа бөөмсөөр шалгах сонгодог туршилтыг дуурайж, түүний үр дүнд үндэслэн санал болгосон. атомын бүтцийн гаригийн загвар .
Анхны шууд судалгааны туршилтууд дотоод бүтэцатомыг 1909-1911 онд Э.Рутерфорд болон түүний хамтран зүтгэгчид Э.Марсден, Х.Гейгер нар гүйцэтгэсэн.
Рутерфорд радиум болон бусад зарим элементүүдийн цацраг идэвхт задралын үед үүсдэг α-бөөмүүдийг ашиглан атомын судалгааг ашиглахыг санал болгов. Альфа бөөмсийн масс нь электроны массаас ойролцоогоор 7300 дахин их, эерэг цэнэг нь энгийн цэнэгээс хоёр дахин их байна. Рутерфорд туршилтандаа 5 МэВ орчим кинетик энергитэй альфа бөөмсийг ашигласан (ийм бөөмийн хурд маш өндөр - ойролцоогоор 107 м/с, гэхдээ гэрлийн хурдаас хамаагүй бага).
α хэсгүүд нь бүрэн ионжсон гелийн атомууд юм. Тэдгээрийг 1899 онд Рутерфорд цацраг идэвхит үзэгдлийг судалж байхдаа нээсэн. Рутерфорд хүнд элементийн атомуудыг (алт, мөнгө, зэс гэх мэт) эдгээр хэсгүүдээр бөмбөгдөв. Атомуудыг бүрдүүлдэг электронууд нь бага масстай тул α бөөмийн траекторийг мэдэгдэхүйц өөрчилж чадахгүй. Тархалт, өөрөөр хэлбэл α-бөөмийн хөдөлгөөний чиглэл өөрчлөгдөх нь зөвхөн атомын хүнд, эерэг цэнэгтэй хэсгээс л үүсдэг. Рутерфордын туршилтын диаграммыг Зураг дээр үзүүлэв. 1.
Хар тугалганы саванд хийсэн цацраг идэвхт эх үүсвэрээс альфа тоосонцорыг нимгэн металл тугалган цаас руу чиглүүлэв. Тарсан хэсгүүд нь цайрын сульфидын талст давхаргаар бүрхэгдсэн дэлгэцэн дээр унасан бөгөөд хурдан цэнэглэгдсэн тоосонцор цохиход гэрэлтэх чадвартай. Дэлгэц дээрх гялбааг (анивчсан) микроскоп ашиглан нүдээр ажиглав. Рутерфордын туршилтын тархсан α бөөмсийн ажиглалтыг цацрагийн анхны чиглэлээс өөр өөр өнцгөөр φ хийж болно. Ихэнх α хэсгүүд нь металлын нимгэн давхаргаар бага зэрэг хазайлтгүйгээр дамждаг нь тогтоогдсон. Гэсэн хэдий ч бөөмсийн багахан хэсэг нь 30 ° -аас дээш мэдэгдэхүйц өнцгөөр хазайдаг. Маш ховор альфа тоосонцор (арван мянганы нэг орчим) 180°-тай ойролцоо өнцгөөр хазайсан байна.
Рутерфорд болон түүний хамтрагчдын хийсэн туршилтууд нь атомын төвд диаметр нь 10-14-10-15 м-ээс хэтрэхгүй нягт эерэг цэнэгтэй цөм байдаг гэсэн дүгнэлтэд хүргэсэн атомын нийт эзэлхүүн, гэхдээ агуулагддаг бүгдэерэг цэнэг ба түүний массын дор хаяж 99.95%. Цөмийн цэнэг нь атомыг бүрдүүлдэг бүх электронуудын нийт цэнэгтэй тэнцүү байх ёстой.
Микробөөмийн хөдөлгөөний талаархи сонгодог санаан дээр үндэслэн Рутерфорд санал болгосон атомын гаригийн загвар . Энэ загварын дагуу атомын төв хэсэгт атомын бараг бүх масс төвлөрсөн эерэг цэнэгтэй цөм байдаг. Атом бүхэлдээ төвийг сахисан байдаг. Цөмөөс ирж буй Кулоны хүчний нөлөөгөөр электронууд гаригуудын нэгэн адил цөмийн эргэн тойронд эргэлддэг. Электронууд цөмд унах тул тайван байж чадахгүй.
Рутерфордын санал болгосон атомын гаригийн загвар нь атомын бүтцийн талаарх мэдлэгийг хөгжүүлэхэд томоохон алхам болсон юм. α-бөөмийн тархалтын туршилтыг тайлбарлах нь зайлшгүй шаардлагатай байсан боловч атомын удаан оршин тогтнох, өөрөөр хэлбэл түүний тогтвортой байдлыг тайлбарлах боломжгүй болсон. Сонгодог электродинамикийн хуулиудын дагуу хурдатгалтай хөдөлж буй цэнэг нь энергийг зөөвөрлөх цахилгаан соронзон долгионыг ялгаруулах ёстой. Богино хугацаанд (ойролцоогоор 10-8 секунд) Рутерфордын атомын бүх электронууд бүх энергиэ зарцуулж, цөм рүү унах ёстой. Атомын тогтвортой төлөвт ийм зүйл тохиолддоггүй нь атом дахь дотоод үйл явц нь сонгодог хуулиудад захирагддаггүйг харуулж байна.
Хэрэглэгч дараахь боломжуудтай:
- суурин алтны цөм дээр бөөмсийн тархалтыг ажиглах;
- бөөмийн цохилтын зай ба анхны хурдыг өөрчлөх;
- бөөмийн тархалтын өнцгийг хэмжих;
- автомат горимд өгөгдсөн энерги бүхий бөөмсийн урсгалаар алтны цөмийг бөмбөгдөх үед тархалтын муруйг судлах.
Атом нь авсаархан, их хэмжээний эерэг цэнэгтэй цөм ба түүний эргэн тойронд сөрөг цэнэгтэй гэрлийн электронуудаас бүрдэнэ.
Эрнест Рутерфорд бол гол нээлтээ хийчихсэн гэдэг утгаараа өвөрмөц эрдэмтэн юм дараахүлээн авч байна Нобелийн шагнал. 1911 онд тэрээр туршилтаа амжилттай хийж, эрдэмтэд атомын гүнийг судалж, түүний бүтцийг олж мэдэх боломжийг олгосон төдийгүй нигүүлсэл, дизайны гүний загвар болсон юм.
Байгалийн эх үүсвэрийг ашиглах цацраг идэвхт цацраг, Рутерфорд бөөмийн чиглэлтэй, төвлөрсөн урсгалыг үүсгэдэг их буу бүтээжээ. Буу нь нарийн нүхтэй хар тугалгатай хайрцаг байсан бөгөөд дотор нь цацраг идэвхт бодис байрлуулсан байв. Үүний улмаас цацраг идэвхт бодисоос нэгээс бусад бүх чиглэлд ялгардаг бөөмс (энэ тохиолдолд альфа бөөмс, хоёр протон, хоёр нейтроноос бүрдэх) тугалган дэлгэцэнд шингэж, зөвхөн альфа бөөмсийн чиглэсэн туяа завсараар ялгардаг байв. . Цаашид цацрагийн зам дагуу нарийн ангархай бүхий хэд хэдэн хар тугалгатай дэлгэцүүд байсан бөгөөд тэдгээр нь тодорхой чиглэлээс хазайсан хэсгүүдийг таслав. Үүний үр дүнд төгс төвлөрсөн альфа бөөмсийн туяа зорилтот тал руу нисч, бай нь өөрөө нимгэн алтан ялтас байв. Альфа туяа түүнд туссан. Тугалган цаасны атомуудтай мөргөлдсөний дараа альфа тоосонцор замаа үргэлжлүүлж, байны ард суурилуулсан гэрэлтэгч дэлгэцийг мөргөж, альфа бөөмсийг онох үед анивчсан дэлгэцийг тэмдэглэв. Тэдгээрээс альфа тоосонцор ямар хэмжээтэй, хэр их чиглэлээс хазайж байгааг турших боломжтой. шулуун хөдөлгөөнтугалган атомуудтай мөргөлдсөний үр дүнд.
Энэ төрлийн туршилтыг өмнө нь хийж байсан. Тэдний гол санаа нь бөөмийн хазайлтын өнцгөөс хангалттай мэдээлэл хуримтлуулж, атомын бүтцийн талаар тодорхой зүйлийг хэлэх явдал байв. Хорьдугаар зууны эхээр атом нь сөрөг цэнэгтэй электрон агуулдаг гэдгийг эрдэмтэд аль хэдийн мэддэг байсан. Гэсэн хэдий ч атом нь сөрөг цэнэгтэй үзэмний электронуудаар дүүрсэн эерэг цэнэгтэй нарийн тор шиг зүйл гэсэн санаа давамгайлж байсан бөгөөд загварыг "үзэмний торны загвар" гэж нэрлэдэг байв. Ийм туршилтын үр дүнд үндэслэн эрдэмтэд атомын зарим шинж чанарыг, ялангуяа тэдгээрийн геометрийн хэмжээсийн дарааллыг тооцоолох боломжтой болсон.
Гэхдээ түүний өмнөх хэн нь ч альфа бөөмс маш том өнцгөөр хазайсан эсэхийг туршилтаар туршиж үзээгүй гэж Рутерфорд тэмдэглэв. Үзэмний торны загвар нь атомд маш нягт, хүнд бүтцийн элементүүд байхыг зөвшөөрөөгүй бөгөөд тэдгээр нь хурдан альфа тоосонцорыг чухал өнцгөөр хазайлгах чадвартай байсан тул хэн ч энэ боломжийг туршиж үзээгүй. Рутерфорд шавь нарынхаа нэгээс уг суурилуулалтыг том хазайлтын өнцгөөр альфа бөөмсийн тархалтыг ажиглах боломжтой байхаар дахин тоноглохыг хүсчээ - зүгээр л ухамсараа цэвэрлэж, энэ боломжийг бүрэн үгүйсгэхийн тулд. Илрүүлэгч нь натрийн сульфидээр бүрсэн дэлгэц байсан бөгөөд альфа тоосонцор цохиход флюресцент туяа үүсгэдэг материал юм. Зарим бөөмс 180° өнцгөөр хазайсан нь зөвхөн туршилтыг шууд гүйцэтгэсэн оюутан төдийгүй Рутерфордын өөрөө ч гайхширсаныг төсөөлөөд үз дээ!
Атомын тогтсон загварын хүрээнд үр дүнг тайлбарлах боломжгүй: үзэмний сүлжээнд хүчирхэг, хурдан бөгөөд хүнд альфа бөөмсийг тусгах юу ч байхгүй. Рутерфорд атом дахь массын дийлэнх нь гайхалтай хэмжээгээр төвлөрдөг гэж дүгнэхэд хүрчээ. нягт бодис, атомын төвд байрладаг. Мөн атомын үлдсэн хэсэг нь урьд өмнө бодож байснаас бага нягтралтай олон тооны дараалалтай болсон. Энэ нь бас тархсан альфа тоосонцоруудын үйлдлээс үзэхэд атомын эдгээр хэт нягт төвүүдэд байдаг нь үүнийг Рутерфорд гэж нэрлэсэн. цөм, атомын эерэг цахилгаан цэнэг бүхэлдээ төвлөрсөн байдаг, учир нь зөвхөн цахилгаан түлхэлтийн хүч нь бөөмсийг 90 ° -аас их өнцөгт тараахад хүргэдэг.
Олон жилийн дараа Рутерфорд нээлтийнхээ талаар энэ зүйрлэлийг ашиглах дуртай байв. Өмнөд Африкийн нэгэн улсын гаалийн ажилтнууд босогчдод зориулж их хэмжээний зэвсгийг хууль бусаар хил нэвтрүүлэх гэж байгааг анхааруулж, зэвсгийг боодолтой хөвөннд нуухыг анхааруулжээ. Одоо гаалийн ажилтан буулгасны дараа хөвөн дүүрэн бүхэл бүтэн агуулахтай тулгарна. Тэр ямар боодолд винтов буу байгааг яаж тодорхойлох вэ? Гаалийн байцаагч асуудлыг энгийнээр шийдсэн: тэр боодол руу буудаж эхэлсэн бөгөөд хэрэв сум нь ямар ч боодолоос урсаж байвал тэр энэ тэмдэг дээр үндэслэн хууль бусаар хил давуулсан зэвсэгтэй боодолуудыг тодорхойлжээ. Тиймээс Рутерфорд альфа тоосонцор алтан тугалган цааснаас хэрхэн урсаж байгааг хараад атомын дотор төсөөлж байснаас хамаагүй нягт бүтэц нуугдаж байгааг ойлгов.
Резерфордын туршилтын үр дүнд үндэслэн зурсан атомын зургийг өнөөдөр бид сайн мэддэг. Атом нь эерэг цэнэг агуулсан хэт нягт, нягт цөм ба эргэн тойронд сөрөг цэнэгтэй гэрлийн электронуудаас бүрддэг. Хожим нь эрдэмтэд энэ зургийн найдвартай онолын үндэслэлийг гаргаж өгсөн ( см.Бор атом), гэхдээ энэ бүхэн цацраг идэвхт материалын жижиг дээж, алтан тугалган цаастай энгийн туршилтаар эхэлсэн.
Мөн үзнэ үү:
Эрнест Рутерфорд, Нелсоны анхны барон Рутерфорд, 1871-1937
Шинэ Зеландын физикч. Нелсон хотод гар урлалын тариачны хүү болон төрсөн. Английн Кембрижийн их сургуульд тэтгэлэгт хамрагдсан. Сургуулиа төгсөөд Канадын МакГиллийн их сургуульд томилогдон Фредерик Содди (1877-1966)-тай хамтран цацраг идэвхт бодисын үзэгдлийн үндсэн хуулиудыг тогтоож, 1908 онд химийн чиглэлээр Нобелийн шагнал хүртжээ. Удалгүй эрдэмтэн Манчестерийн их сургуульд нүүж, түүний удирдлаган дор Ханс Гейгер (1882-1945) өөрийн алдарт Гейгер тоолуураа зохион бүтээж, атомын бүтцийг судалж, 1911 онд атомын цөм байдгийг илрүүлжээ. Дэлхийн нэгдүгээр дайны үед тэрээр дайсны шумбагч онгоцыг илрүүлэх сонар (акустик радар) бүтээх ажилд оролцож байжээ. 1919 онд тэрээр Кембрижийн их сургуулийн физикийн профессор, Кавендишийн лабораторийн эрхлэгчээр томилогдсон бөгөөд тэр жилдээ хүнд бөөмсөөр бөмбөгдсөний үр дүнд цөмийн задралыг нээсэн. өндөр энерги. Рутерфорд амьдралынхаа эцэс хүртэл энэ албан тушаалд үлдэж, олон жилийн турш Хатан хааны ерөнхийлөгчөөр ажилласан шинжлэх ухааны нийгэм. Түүнийг Вестминстерийн сүмд Ньютон, Дарвин, Фарадей нарын дэргэд оршуулжээ.
Рутерфордын альфа бөөмсийг тараах туршилтаас гарсан дүгнэлт: 1. Атомын цөм байдаг, өөрөөр хэлбэл. атомын бараг бүх масс, бүх эерэг цэнэг нь төвлөрсөн жижиг бие. 2. Атомын бараг бүхэлдээ масс нь цөмд төвлөрдөг. 3. Сөрөг бөөмс - электронууд - хаалттай тойрог замд цөмийг тойрон эргэлддэг. 4. Бүх электронуудын сөрөг цэнэг атомын нийт эзэлхүүний хэмжээнд тархсан. Атомын цөмийн загвар:
Слайд 9танилцуулгаас "Рутерфордын туршилт, атомын загвар".Танилцуулга бүхий архивын хэмжээ 174 KB байна.
Физик 9-р ангихураангуй"Элементийн атомын бүтэц" - Цацраг идэвхт байдлын үзэгдлийг нээсэн хүн. Бүтэц. Атом бол "хуваашгүй" юм. Рутерфорд атомын бүтэц, найрлагыг судлах хэд хэдэн туршилт хийсэн. Томсон 1903 онд атомын бүтцийн анхны загваруудын нэгийг санал болгосон. Анри Беккерел цацраг идэвхт байдлын үзэгдлийг нээсэн. Бөөм нь дэлгэцэн дээр гялалзах шалтгаан болсон. 19-р зууны төгсгөлд болсон хоёр үйл явдал нь атомын нарийн бүтэцтэй байх санааг бий болгосон. Атомын бүтэц. Гаригийн (цөмийн) загвар.
"Үүлэн камер" - Төхөөрөмжийн зорилго. Роботын зарчим. Сайжруулалт. Хүчин чадал. Төхөөрөмжийн зохион бүтээгч. Утга. Камер. Вилсон. Вилсоны танхим. Төхөөрөмж.
“Цөмийн энергийн аюулгүй байдал” - Түүхээс цөмийн эрчим хүч. Ураны цөмийн задралын урвал. Буцалж буй цөмийн реакторын ажиллагааны диаграмм. Аюулгүй байдал. Буцалж буй цөмийн реакторын диаграм. Атомын цахилгаан станцууд эрчим хүч үйлдвэрлэх илүү чадвартай. Атомын цахилгаан станцууд. Цөмийн энергийн хор хөнөөл. ОХУ-ын газрын зураг дээрх атомын цахилгаан станцууд. Цөмийн реактор. Цөмийн энерги. Fusion. Цөмийн энергийн ашиг тус, хор хөнөөл. Цөмийн мөс зүсэгч хөлөг онгоцууд.
"Физик "Хөдөлгөөн" - Биеийн харилцан үйлчлэл. Механик. Механик дахь хадгалалтын хууль. Атомын бүтэц. Биеийн инерци ба масс. Хурд жигд бус хөдөлгөөн. Координатууд хэрхэн өөрчлөгддөг. Шулуун шугамаар хөдөлж байна жигд хурдасгасан хөдөлгөөн. Динамикийн үндэс. Хүчний ажил. Ньютоны 2-р хууль. Биеийн чөлөөт уналт. Физикийн үндэс. Бодисын шинж чанарыг судлах. Вектор. Ньютоны 3-р хууль. Цусны эргэлтийн хугацаа ба давтамж. Хурдатгал. Физик бол яг нарийн шинжлэх ухаан юм.
"Математикийн дүүжингийн хэлбэлзэл" - Хичээлийн төлөвлөгөө. Практик хэрэглээдүүжин хэлбэлзэл. Галилео Галилей (1564-1642). Гюйгенс Кристиан (1629-1695). Аливаа бие нь хэлбэлзлийн хөдөлгөөнийг хийж чадна. Туршилтыг нарийн тойрогт хийсэн. Дүрслэл механик чичиргээФуко дүүжингийн жишээг ашиглан. Пизагийн их сургуулийн хуучин барилга. Утасны урт нь түүн дээр бэхлэгдсэн биеийн хэмжээнээс хамаагүй их байвал жинхэнэ дүүжинг математик гэж үзэж болно.
"Анхны сансрын хурд" - Асуудлыг шийдвэрлэх. Чөлөөт уналтыг хурдасгах. Биеийг хиймэл дагуул болгохын тулд түүнд өгөх ёстой хурд. Хиймэл хиймэл дагуулын танилцуулга. Эхний зугтах хурд. Бие нь хиймэл оюун ухаан болох нөхцөл. Хиймэл хиймэл дагуулуудДэлхий. Хиймэл дагуул хөөргөх анхны зугтах хурдыг тодорхойлох. Асуудлыг шийд. Нарыг тойрсон гаригуудын хувьсгал.
Холбоотой нийтлэлүүд
-
Үндэстний мөргөлдөөн, түүний шалтгаануудын жишээ
иргэний, улс төрийн хэлбэр эсвэл зэвсэгт сөргөлдөөн, үүнд талууд, эсвэл талуудын аль нэг нь угсаатны үндэслэлээр дайчлах, үйлдэл хийх, зовж шаналах. ялгаа. K. e. Бүлгүүдийн хоорондох өрсөлдөөний янз бүрийн төрлийг ойлгох хэрэгтэй - ...
-
Хавтангийн тектоник Контурын зураг дээр литосферийн ялтсуудыг заана уу
Плит тектоник нь литосферийн ялтсуудын хөдөлгөөн ба харилцан үйлчлэлийн тухай орчин үеийн геологийн онол юм.
-
"Тектоник" гэдэг үг нь Грекийн "тектон" - "барилгачин" буюу "мужаан" гэсэн үгнээс гаралтай бөгөөд энэ нь тектоникийн хавтангууд нь аварга том блокуудын нэр юм.
Аракчеевогийн тухай Пушкины цэргийн суурингууд
-
Алексей Андреевич Аракчеев (1769-1834) - Оросын төрийн зүтгэлтэн, цэргийн удирдагч, гүн (1799), артиллерийн генерал (1807). Тэрээр Аракчеевын язгууртан гэр бүлээс гаралтай. Тэрээр I Паулын үед нэр хүндтэй болж, цэрэг армидаа хувь нэмрээ оруулсан...
Гэртээ хийх энгийн физик туршилтууд
-
Хичээлийн зорилго, зорилтыг тодорхойлох, шинэ сэдвийг судлахдаа асуудлын нөхцөл байдлыг бий болгох, шинэ мэдлэгийг нэгтгэх үед ашиглах үе шатуудад физикийн хичээлд ашиглаж болно. Оюутнууд “Цэцвэртэй туршилтууд” илтгэлийг...
Камерын механизмын динамик синтез Кам механизмын хөдөлгөөний синусоид хуулийн жишээ
-
Камер механизм нь гаралтын холбоосыг тогтвортой байлгах чадвартай, өндөр кинематик хостой механизм бөгөөд бүтэц нь хувьсах муруйлттай ажлын гадаргуутай дор хаяж нэг холбоосыг агуулдаг. Камер механизмууд...
Глаголев FM подкастын бүх шоуны дайн эхлээгүй байна
