Glicin (aminoocetna kislina, glikokol, Gly, G). Kemijske lastnosti Natrijeva sol aminokisline
I. Po številu funkcionalnih skupin
Monoaminomono karboksilne kisline
najpreprostejši predstavnik:

Monoaminodikarboksilne kisline

Na primer:

Diaminomonokarboksilne kisline

Na primer:

II. Avtor: medsebojni položaj karboksilne in amino skupine
-α-aminokisline

- β-aminokisline

- γ-aminokisline

Formule in imena nekaterih α-aminokislin, katerih ostanki so del beljakovin

Beljakovine so naravni polimeri, iz katerih so zgrajene makromolekule veliko število ostanki 20 različnih α-aminokislin. V biokemiji se za aminokisline običajno uporabljajo kratka, trivialna imena in tričrkovne oznake.
Monoaminomonokarboksilne kisline
|
Aminoetanojska ali aminoocetna kislina ali glicin (glikokol) |
|
|
2-aminopropanojsko ali α-aminopropionsko kislino ali alanin |
|
|
2-amino-3-hidroksipropanojska ali α-amino-β-hidroksipropionska kislina ali serin |
|
|
2-amino-3-merkaptopropanojska kislina ali β-merkaptoalanin ali cistein |
|
|
2-amino-3-fenilpropanojska kislina ali β-fenilalanin ali fenilalanin |
|
|
2-amino-3-(4-hidroksifenil)-propanojska kislina ali β-(n-hidroksifenil)-apanin ali tirozin |
|
|
2-amino-3-metilbutanojska kislina ali α-aminoizovalerijanska kislina ali valin |
Monoaminodikarboksilne kisline
Diaminomonokarboksilna kislina
Razvrstitev naravnih aminokislin
I. Zamenljive aminokisline – lahko se sintetizirajo v človeškem telesu. Ti med drugim vključujejo: glicin, alanin, serin, cistein, tirozin, asparaginsko in glutaminsko kislino.
II. Esencialnih aminokislin človeško telo ne more sintetizirati in jih mora telo vnesti kot del beljakovin iz hrane. Fenilalanin, valin, lizin so predstavniki esencialnih aminokislin.
Fizikalne lastnosti
Večina aminokislin je brezbarvnih kristalne snovi, zelo topen v vodi. Veliko aminokislin ima sladek okus. Tališča različnih aminokislin se gibljejo med 230-300°C.
Kemijske lastnosti
Aminokisline so amfoterne spojine, kar je posledica prisotnosti v njihovih molekulah funkcionalnih skupin kisle (-COOH) in bazične (-NH 2) narave.
1. Interakcija z bazami

2. Interakcija s kislinami

3. Tvorba notranjih soli (bipolarni ioni)
V vodnih raztopinah obstajajo aminokisline v obliki ravnotežnih mešanic molekul in bipolarnih ionov, ki kislo okolje prehajajo v kationsko obliko in v alkalno okolje- v anionsko obliko.
a) Monoaminomonokarboksilne kisline

Ko nastanejo notranje soli monoaminomonokarboksilnih kislin, se narava medija ne spremeni. Zato se te aminokisline imenujejo nevtralne. Skupni naboj notranjih soli takih kislin je nič.
Ko dodamo kislino (H+), se karboksilatni ion protonira, tako da na skupini -NH ostane samo pozitiven naboj.
b) Monoaminodikarboksilne kisline

Ko nastanejo notranje soli monoaminodikarboksilnih kislin, nastane presežek vodikovih ionov, zato imajo vodne raztopine teh kislin pH
c) Diaminomonokarboksilne kisline

Pri nastanku notranjih soli diaminomonokarboksilnih kislin nastane presežek hidroksidnih ionov, zato imajo njihove vodne raztopine pH > 7. Take aminokisline imenujemo bazične. Skupni naboj notranjih soli bazičnih aminokislin je pozitiven.
4. Tvorba peptidov
Ko karboksilna skupina ene molekule aminokisline medsebojno deluje z amino skupino druge molekule aminokisline, nastanejo dipeptidi:

Pri interakciji dveh različnih aminokislin nastane mešanica štirih dipeptidov; Na primer:

Dipeptid lahko z dodajanjem druge molekule aminokisline tvori tripeptid. Podobno lahko tetrapeptid dobimo iz tripeptida itd.
5. Tvorba derivatov na karboksilni skupini
Tako kot karboksilne kisline lahko tudi aminokisline tvorijo estre, kislinske kloride itd. Na primer:

6. Polikondenzacija ε-aminokaprojske kisline

Metode pridobivanja
1. Amonoliza α-halokarboksilnih kislin
2. Hidroliza beljakovin
Aminokisline – to so derivati organskih kislin, ki vsebujejo eno ali več amino skupin (NH 2) v radikalu.
V skladu z racionalno nomenklaturo imajo njihova imena predpono "amino" in črke grške abecede (α-, β-, γ- itd.), Ki označujejo položaj amino skupine glede na karboksilno skupino.
4-aminobutan
(γ-aminobutirična)
Beljakovine vsebujejo α-aminokisline, ki imajo trivialna imena.
Aminokisline delimo na monoaminokarboksilne, aminodikarboksilne, aromatske in heterociklične: CH 3 –CHNH 2 –COOH alanin (α-aminopropionska kislina) 4 –CHNH 2 –COOH lizin (α,ε-); diaminokapronska kislina); COOH–CH 2 –CHNH 2 –COOH asparaginska kislina (α-aminojantarna kislina); C 6 H 5 –CH 2 –CHNH 2 –COOH fenilalanin (α-amino-β-fenilpropionska kislina);

(pirolidin-α-karboksilna kislina).
Vse α-aminokisline, ki jih pogosto najdemo v živih organizmih, imajo trivialna imena, ki se običajno uporabljajo v literaturi.
Lastnosti aminokislin. Aminokisline so kristalne snovi, običajno sladkastega okusa, zlahka topne v vodi.
Glede na število amino ali karboksilnih funkcionalnih skupin v aminokislini ima lahko bazične (lizin) ali kisle lastnosti (asparaginska kislina).
Amino skupina in karboksilna skupina lahko tvorita bipolarni ion ali notranjo sol:
NH 2 –CH 2 –COOH →NH 3 + –CH 2 –COO – .
Prisotnost skupin –NH 2 in –COOH v aminokislinah določa njihove amfoterne lastnosti (medsebojno delujejo z bazami in kislinami).
H 2 N–CH 2 –COOH +NaOH→H 2 N–CH 2 –COONa+ H 2 O
natrijeva sol glicina
H 2 N–CH 2 –COOH +HCl→Cl –
sol glicin hidroklorida
Aminokisline tvorijo estre z alkoholi.
H 2 N–CH 2 –COOH + NOCH 3  NH 2 –CH 2 –COOCH 3 + H 2 O
NH 2 –CH 2 –COOCH 3 + H 2 O
glicin metil ester
Značilna je tvorba znotrajkompleksnih bakrovih soli; reakcijo lahko uporabimo za izolacijo aminokislin.

bakrovo glicinsko sol
Pri segrevanju se α-aminokisline pretvorijo v 1,4-diketopiperazine.

β  -Aminokisline pri segrevanju zlahka izgubijo amoniak, pri čemer nastanejo nenasičene kisline.
-Aminokisline pri segrevanju zlahka izgubijo amoniak, pri čemer nastanejo nenasičene kisline.
akrilna kislina
γ, δ, ε-aminokisline se pri segrevanju pretvorijo v ciklične amide - laktame.

kaprolaktam ε-aminokaprojske kisline
Večji del tega izdelka se porabi za proizvodnjo poliamidnih vlaken - najlona.
Aminokisline, ki vsebujejo amino skupino v položaju α, so podvržene reakciji dehidracije, da tvorijo polipeptide.
glicin alanin cistein
Ime polipeptida je sestavljeno iz imen kislinskih radikalov in polnega imena kisline, v kateri je shranjena karboksilna skupina.
Metode pridobivanja. Aminokisline lahko dobimo s hidrolizo beljakovin ali iz halogeniranih kislin pod delovanjem amoniaka:
alanin α-bromopropionske kisline
α-aminokisline so del beljakovinske sestavine hrane in jih delimo na nadomestljive in nenadomestljive.
Neesencialne aminokisline lahko sintetizira človeško ali živalsko telo. Esencialne aminokisline (metionin, valin, levcin, fenilalanin, izolevcin, triptofan, lizin, treonin) ne nastajajo v živem organizmu in jih moramo za svoje normalno delovanje zaužiti s hrano. Na primer, pomanjkanje lizina vpliva na hematopoetsko funkcijo in kalcifikacijo kosti; metionin ima antisklerotični učinek; triptofan je pomemben za proces rasti in metabolizem.
Naravni vir α-aminokislin so beljakovinske snovi (med hidrolizo).
Aminokisline so sestavni del rastlin, mikroorganizmov, živali in človeka ter igrajo ogromno vlogo v življenjskih procesih organizmov.
Veverice – to so naravne visokomolekularne dušik vsebujoče organske spojine, katerih molekule so zgrajene iz α-aminokislin, povezanih s peptidnimi vezmi, torej so beljakovine polipeptidi.
ravnotežje ravnotežje ravnovesje
alanin serin cistein
Beljakovine so zelo razširjene v naravi, predvsem pri živalih in ljudeh. Velika količina Beljakovine najdemo v kosteh, hrustancu, mišicah in živčnem tkivu. Beljakovine sestavljajo dlako, volno, perje, ribje luske, kopita, rogove itd. Beljakovine najdemo v ptičjih jajcih in so del mleka, krvi itd. Encimi, hormoni in virusi so prav tako beljakovinske narave.
Struktura beljakovin. Vse beljakovine vsebujejo ogljik, vodik, kisik, dušik (redko S, P, Fe).
Molekulska masa beljakovin je izjemno velika - od 5000 do več milijonov.
Zaporedje, s katerim so povezani α-aminokislinski ostanki v verigi, se imenuje primarna struktura veverica. Za vsako vrsto beljakovin je strogo edinstven.
Polipeptidna veriga je običajno v obliki vijačnice. Tendenca polipeptidne verige, da se zvije v vijačnico, je določena s primarno strukturo proteina, vendar je njegova moč določena s tvorbo vodikovih vezi med skupinami  in –NH– sosednjih zavojev vijačnice.
in –NH– sosednjih zavojev vijačnice.
Na primer:

Posebnost zvijanja polipeptidnih verig beljakovinskih molekul v spiralo se imenuje sekundarna struktura beljakovine.
Zavoji vijačnice so lahko tako ali drugače upognjeni zaradi prisotnosti disulfidnih mostov –S–S–, ki držijo določene zavoje v neposredni bližini; to vlogo lahko igra tudi vodikove vezi. Zaradi tega zgibanja odsekov spirale nastane podoba krogle. Ta oblika strukture beljakovin se imenuje terciarna struktura.
V molekulah nekaterih beljakovin se tvori več takih "kroglic" (globul), zaradi česar pojavi se kvartarna struktura. Vezi, ki povezujejo beljakovinske podenote v molekulo s kvartarno strukturo, niso kovalentne, temveč šibkejše vezi, kot so vodikove (kot v molekuli hemoglobina), ionske ali ti hidrofobne interakcije. Proteini s kvartarno strukturo imajo zaradi krhkosti vezi, ki povezujejo podenote, sposobnost reverzibilne disociacije na podenote. V tem primeru lahko izgine encimska aktivnost beljakovin.
Razvrstitev beljakovin. Beljakovine delimo v dve glavni skupini: beljakovine (enostavne beljakovine) in proteide (kompleksne beljakovine). Beljakovine so sestavljene le iz aminokislin in pri hidrolizi ne tvorijo drugih produktov. Proteidi so sestavljeni iz beljakovinskega dela, zgrajenega iz α-aminokislin, in neproteinskega dela (prostetična skupina). Pri hidrolizi ti proteini poleg α-aminokislin dobavljajo tudi druge snovi: ogljikove hidrate, fosforno kislino, heterociklične spojine, barvila itd.
Na beljakovine se nanaša na številne enostavne proteine, ki imajo različne topnosti v različnih topilih.
albumin – beljakovine, ki so topne v vodi, se ne oborijo z nasičeno raztopino natrijevega klorida, ampak se oborijo z nasičeno raztopino amonijevega sulfata in pri segrevanju koagulirajo. Predstavniki: albumini jajc, mleka, krvnega seruma, beljakovine encimov in rastlinskih semen.
Globulini – beljakovine, ki so netopne v vodi, vendar topne v razredčenih raztopinah soli; pri segrevanju koagulirajo. Imajo večjo molekulsko maso kot albumin. Predstavniki: globulini mleka, jajc, krvi, mišične beljakovine (miozin), semena rastlin.
Prolamini – beljakovine, topne v 70–80 % alkoholu, netopne v vodi in brezvodnem alkoholu. Pri vrenju se ne sesirijo. Predstavniki: žitne beljakovine (gliadin - v pšenici, zein - v koruzi).
glutelini – rastlinske beljakovine, netopne v nevtralnih solnih raztopinah in v etilni alkohol; raztopimo samo v razredčenih (0,2%) raztopinah alkalij. Vsebuje predvsem semena žit. Glutelini v nekaterih žitih se imenujejo glutenini (iz besede gluten).
Histoni – beljakovine bazične narave, saj vsebujejo znatno količino diaminokislin, topnih v vodi in razredčenih kislinah, vendar netopnih v razredčenih alkalijah. Običajno predstavljajo proteinske dele kompleksnih proteinov. Predstavniki: globin je beljakovina, ki je del hemoglobina.
Protamini – najpreprostejši naravni proteini z nizko molekulsko maso; Sestavljeni so pretežno iz diamino kislin in so močne baze. Dobro topen v vodi, razredčenih kislinah in alkalijah. Pri segrevanju ne koagulira. Predstavnike protaminov najdemo v semenčicah rib, kot del kompleksnih beljakovin - nukleoproteinov.
Albuminoidi(skleroproteini) so beljakovine, ki se po lastnostih močno razlikujejo od drugih beljakovin. Raztapljajo se le pri dolgotrajni obdelavi s koncentriranimi kislinami in alkalijami z delitvijo molekul. V živalskih organizmih opravljajo podporne in pokrovne funkcije, vendar jih v rastlinah ne najdemo. Predstavniki skleroproteinov so: fibroin – svilena beljakovina; keratin - beljakovina dlake, volne, poroženele snovi, povrhnjice kože; elastin je beljakovina v stenah krvnih žil in kit; Kolagen je beljakovinska snov kože, kosti, hrustanca in vezivnega tkiva.
Proteidi – kompleksne beljakovine, razdeljene v podskupine glede na naravo protetičnega (neproteinskega) dela.
fosfoproteini – proteini, ki vsebujejo ostanek fosforne kisline kot protetično skupino. Predstavniki: kazein - mlečna beljakovina, vitelin - beljakovina, ki se nahaja v rumenjaku kokošjih jajc.
Nukleoproteini – beljakovine, pri katerih je sam proteinski del povezan s nukleinske kisline, slednji pa ob hidrolizi tvorijo fosforno kislino, heterociklične spojine in ogljikove hidrate. Nukleoproteini so del jeder rastlinskih in živalskih celic.
Kromoproteini – snovi, v katerih je beljakovinski del kombiniran z barvilom. Predstavnik: hemoglobin v krvi se med hidrolizo razgradi, pri čemer nastane beljakovina globin in barvilo - hem.
Glukoproteini – beljakovine, v katerih je beljakovinski del združen z ogljikovimi hidrati. Predstavnik: mucin, ki je del sline.
Lipoproteini – povezave beljakovin z lipidi; slednji vključujejo maščobe, fosfatide itd. Lipoproteini se nahajajo v protoplazmi celic, v krvnem serumu in v jajčnem rumenjaku.
Beljakovine so razvrščene tudi glede na obliko njihovih molekul, razdeljene v dve skupini:
a) fibrilarni (vlaknasti) proteini, katerih molekule imajo nitasto obliko; ti vključujejo fibroin svile, keratin volne, mišični miozin;
b) globularne beljakovine, katerih molekule imajo okroglo obliko; ti vključujejo albumine, globuline in številne kompleksne beljakovine.
Hranilna vrednost beljakovin je določena s kvalitativno in kvantitativno sestavo aminokislin, ki jih vsebujejo. Obstajajo popolne in nepopolne beljakovine.
Popolne beljakovine vsebujejo vse esencialne aminokisline (mlečni kazein, jajčni albumin, mesne beljakovine).
Nepopolne beljakovine so tiste, ki ne vsebujejo vsaj ene od esencialnih aminokislin (koruzni zein, želatina).
Lastnosti beljakovin. Beljakovine se razlikujejo po agregatnem stanju. Pogosto so to trdne amorfne snovi, ki izgledajo kot beli prah. Proteini volne (keratin) in svile (fibroin) so močna vlakna. Nekatere beljakovine dobimo v kristalnem stanju (hemoglobin v krvi), mnoge imajo konsistenco viskoznih tekočin ali želejev.
Vse beljakovine so netopne v brezvodnem alkoholu in drugih organskih topilih. Veliko proteinov se raztopi v vodi in v razredčenih raztopinah soli, vendar tvorijo koloidne raztopine in ne prave. Obstajajo beljakovine, ki so popolnoma netopne v vodi.
Raztopine naravnih proteinov so optično aktivne (večinoma imajo levo rotacijo).
Beljakovine so tako kot aminokisline amfoterne in tvorijo soli s kislinami in bazami:
H 3 N + –R–COO – + H + + Cl –  NH 3 + –R–COOH + Сl – ;
NH 3 + –R–COOH + Сl – ;
H 3 N + –R–COO – + Na + + OH –  NH 2 –R–COO – + Na + + H 2 O.
NH 2 –R–COO – + Na + + H 2 O.
V prisotnosti kislin imajo proteinske molekule pozitiven naboj in se med elektrolizo premaknejo na katodo; v prisotnosti alkalij imajo proteinske molekule negativen naboj in se premaknejo na anodo. Pri določeni vrednosti pH bo raztopina vsebovala minimalno količino proteinskih kationov in anionov; v teh pogojih ne pride do gibanja beljakovinskih molekul med elektroforezo. Imenuje se pH vrednost raztopine, pri kateri raztopina beljakovin vsebuje najmanjšo količino kationov in anionov izoelektrična točka. Pri različnih proteinih vrednost izoelektrične točke ni enaka. Na primer, za jajčni beljak (albumin) je izoelektrična točka pri pH = 4,8, za pšenične beljakovine (gliadin) - pri pH = 9,8.
Vsi proteini imajo nekatere skupne lastnosti: reakcije obarjanja iz raztopin in barvne reakcije.
Obarjanje proteinov iz raztopin. Ko je dodano k vodne raztopine beljakovine iz koncentriranih raztopin mineralnih soli (npr. (NH 4) 2 SO 4), beljakovine se oborijo; alkohol in aceton imata podoben učinek na beljakovine. V vseh teh primerih beljakovine ne spremenijo svojih lastnosti in se, ko se razredčijo z vodo, vrnejo v raztopino. Ta proces se imenuje soljenje.
Pri segrevanju mnoge beljakovine koagulirajo (na primer jajčni beljak) in se tudi oborijo iz raztopin, vendar izgubijo sposobnost raztapljanja v vodi. V tem primeru pride do pomembne spremembe lastnosti beljakovin. Ta proces ireverzibilnega obarjanja beljakovin se imenuje denaturacija. Denaturacijo lahko povzročijo soli težkih kovin (CuSO 4, Pb(CH 3 COO) 2, HgCl itd.), koncentrirane kisline (HNO 3, H 2 SO 4, CH 3 COOH, pikrinska, kloroocetna), jedke alkalije ( KOH, NaOH), fenol, formalin, tanin itd.
Denaturacijo beljakovin povzročajo tudi različne vrste sevanja (ultravijolično, radioaktivno itd.). Med denaturacijo se uničijo kvartarne, terciarne in sekundarne strukture; primarna struktura je običajno ohranjena, to pomeni, da ne pride do uničenja peptidnih vezi. Primarna struktura beljakovin se uniči med hidrolizo beljakovin, ki se pojavi med prebavo beljakovinskih živil. V prebavnem traktu se pod delovanjem encimov beljakovine hrane skozi vrsto vmesnih produktov razgradijo v aminokisline. Iz kombinacije pridobljenih aminokislin telo ustvari beljakovine, ki jih potrebuje. Neuporabljeni ostanki beljakovin se razgradijo v enostavnejše spojine in izločijo iz telesa.
Barvne reakcije proteinov.
1. Biuretna reakcija.
Pri interakciji z bakrovimi solmi (CuSO 4) v alkalnem mediju vsi proteini dajejo vijolično barvo. Ta reakcija je kvalitativna peptidne vezi in potrjuje njihovo prisotnost v proteinih in polipeptidih. Pri različnih polipeptidih barva, ki se pojavi pri interakciji z bakrovimi solmi, ni enaka: dipeptidi dajejo modro barvo, tripeptidi dajejo vijolično barvo, kompleksnejši polipeptidi pa dajejo rdečo barvo.
2. Ksantoproteinska reakcija.
Ko raztopine beljakovin segrejemo s koncentrirano dušikovo kislino (HNO 3), postanejo rumene. Reakcijo pojasnjujejo s prisotnostjo v beljakovinah aminokislin, ki vsebujejo aromatske ogljikovodikove radikale (C 6 H 5 –), ki pri interakciji z dušikova kislina tvorijo nitro spojine, obarvane rumeno.
3. Cistinska reakcija (sulfhidril).
Če zavremo raztopino beljakovin s presežkom natrijevega hidroksida in dodamo nekaj kapljic raztopine svinčevega acetata Pb(CH 3 COO) 2, se pojavi rjavo-črna barva ali oborina.
Beljakovine + NaOH  Na 2 S+ druge snovi.
Na 2 S+ druge snovi.
Na 2 S + Pb(CH 3 COO) 2 → PbS↓ + 2CH 3 COONa.
Reakcija potrdi prisotnost šibko vezanega žvepla v beljakovinah.
Obstajajo številne druge kvalitativne reakcije na beljakovine.
Pomen in uporaba beljakovin. Beljakovine so najpomembnejša sestavina živil. Več kot 50 % beljakovin v človeški prehrani bi morale biti živalske beljakovine. Odrasla oseba potrebuje 80–100 g beljakovin na dan, s težkimi telesnimi aktivnostmi pa 120 g ali več.
Proteinske snovi se pogosto uporabljajo v proizvodnji industrijskih izdelkov (usnje, volna, krzno, svila), v proizvodnji lepila, želatine, umetnih mas (galalit), umetne volne, za pripravo fotoobčutljivih emulzij v fotoindustriji itd.
Mnogi zdravila imajo beljakovinsko naravo (insulin, pankreatin itd.). Posebno pozornost je treba nameniti biološkim katalizatorjem - encimom, ki so tudi beljakovinske snovi. Pogosto so prisotni le v majhnih količinah in prispevajo k hitrim kemičnim pretvorbam ogromnih količin različnih snovi v zelo blagih pogojih (nizka temperatura itd.).
Virusi in bakterije imajo tudi beljakovinsko naravo. Zato se pri konzerviranju živil in zdravljenju različnih bolezni uporabljajo zdravila, ki denaturirajo beljakovinske snovi (salicilna kislina, aspirin, salol, tanin, različni polifenoli, ocetna kislina itd.).
Beljakovine so snovi, ki so nujno potrebne za življenje živali, rastlin in mikroorganizmov. Samo življenje je proces zapletenih transformacij beljakovinskih snovi.
Glicin (aminoocetna kislina, glikokol, Gly, G)
H2NCH2COOH
Molekulska teža 75,07; brezbarvni kristali; t taljenje 232-236°C (z razgradnjo); zelo topen v vodi, netopen v večini organskih topil. Pri 25°C p K a 2,34 (COOH) in 9,6 (NH2); r jaz 5,97.
Glede na kemijske lastnosti je glicin tipična alifatska α-aminokislina. Kvantitativno določanje temelji na tvorbi obarvanih produktov z o-ftalaldehidom (Zimmermannova reakcija). Pogosteje se nahaja v beljakovinah kot druge aminokisline. Služi kot prekurzor v biosintezi porfirinskih spojin in purinskih baz. Glicin je kodirana aminokislina, neesencialna; njegova biosinteza poteka s transaminacijo glioksilne kisline, encimsko cepitvijo serina in treonina. Licin se sintetizira iz kloroocetne kisline in NH 3 . V NMR spektru v D 2 O je kemijski premik protonov skupine CH 2 3,55 ppm. Notranja sol glicina (CH 3) 3 + NCH 2 COO se imenuje betain.
Glicin se uporablja za sintezo peptidov, kot sestavina puferskih raztopin, v mešanici z drugimi aminokislinami - za parenteralno prehrano.
Kromatogrami vzorcev, ki vsebujejo to snov
Aminokisline so organske amfoterne spojine. V molekuli vsebujejo dve funkcionalni skupini nasprotne narave: amino skupino z bazičnimi lastnostmi in karboksilno skupino s kislimi lastnostmi. Aminokisline reagirajo s kislinami in bazami:
H 2 N -CH 2 -COOH + HCl → Cl [H 3 N-CH 2 -COOH],
H 2 N -CH 2 -COOH + NaOH → H 2 N-CH 2 -COONa + H 2 O.
Ko se aminokisline raztopijo v vodi, karboksilna skupina odstrani vodikov ion, ki se lahko veže na amino skupino. V tem primeru nastane notranja sol, katere molekula je bipolarni ion:
H 2 N-CH 2 -COOH + H 3 N -CH 2 -COO - .
Kislinsko-bazične transformacije aminokislin v različna okolja lahko predstavimo z naslednjim splošnim diagramom:

Vodne raztopine aminokislin imajo glede na število funkcionalnih skupin nevtralno, alkalno ali kislo okolje. Tako glutaminska kislina tvori kislo raztopino (dve -COOH skupini, ena -NH 2), lizin pa alkalno raztopino (ena -COOH skupina, dve -NH 2).
Tako kot primarni amini tudi aminokisline reagirajo z dušikovo kislino, pri čemer se amino skupina pretvori v hidrokso skupino, aminokislina pa v hidroksi kislino:
H 2 N-CH(R)-COOH + HNO 2 → HO-CH(R)-COOH + N 2 + H 2 O
Merjenje volumna sproščenega dušika nam omogoča določitev količine aminokislin ( Metoda Van Slyke).
Aminokisline lahko reagirajo z alkoholi v prisotnosti plina klorovodika in se spremenijo v ester(natančneje v hidrokloridno sol etra):
H 2 N-CH(R)-COOH + R’OH H 2 N-CH(R)-COOR’ + H 2 O.
Estri aminokislin nimajo bipolarne strukture in so hlapne spojine.
Najpomembnejša lastnost aminokislin je njihova sposobnost kondenzacije v tvorbo peptidov.
Kvalitativne reakcije.
1) Vse aminokisline oksidira ninhidrin

s tvorbo obarvanih izdelkov modro-vijolična barva. Iminokislina prolin daje rumeno barvo z ninhidrinom. To reakcijo lahko uporabimo za kvantifikacijo aminokislin s spektrofotometrijo.
2) Ko aromatske aminokisline segrejemo s koncentrirano dušikovo kislino, pride do nitracije benzenovega obroča in obarvane spojine rumena. Ta reakcija se imenuje ksantoprotein(iz grškega xanthosa - rumeno).
Beljakovine so polipeptidi s precej veliko molekulsko maso, ki imajo določeno prostorsko strukturo, ki je odvisna od zaporedja aminokislin, vključenih v beljakovinsko verigo. Ta struktura je lahko kompaktna (globularni proteini) ali podolgovata (fibrilarni proteini). Vsi encimi so globularni proteini, fibrilarni proteini vključujejo kolagen, keratin - proteini kože in las, zelo močni in zelo raztegljivi.
Beljakovine glede na sestavo delimo na enostavne, sestavljene samo iz aminokislin, in sestavljene beljakovine – komplekse oz. kovalentne spojine polipeptidi z molekulami drugih razredov:
nukleinske kisline – nukleoproteini;
polisaharidi - glikoproteini;
lipidi – lipoproteini;
pigmenti – kromoproteini;
ostanki fosforne kisline - fosfoproteini.
Proteinski del kompleksne beljakovine se imenuje apobelcom, nebeljakovinsko – protetična skupina. Skoraj vsi enostavni in kompleksni globularni proteini so encimi - biološki katalizatorji biokemičnih reakcij v živih organizmih.
Naloge
Naloga 1. Kolikšna količina plina (v normalnih pogojih) se bo sprostila med reakcijo z dušikova kislina 0,001 mol aminokisline: a) levcin; b) lizin; c) prolin?
rešitev
Zapišimo enačbe za reakcije naštetih aminokislin z dušikovo kislino.
V primeru levcina in lizina pride do deaminacije po Van Slykeu, pri lizinu pa na dveh amino skupinah, ki jih vsebuje molekula. Prolin nima primarne amino skupine, zato se proces ustavi na stopnji N-nitrozacije. Pri reakciji (a) je število molov levcina n(Leu) enako številu molov sproščenega dušika n(N2), torej se sprosti 0,001 mol ali 22,4 ml dušika. V reakciji (b)
nastane dvojna količina plina 2n(N 2) v primerjavi z n(lys), saj ima prvotna aminokislina dve primarni amino skupini; prostornina sproščenega dušika bo 44,8 ml. Pri reakciji (c) se dušik ne sprosti: prolin je edina izmed 20 esencialnih aminokislin, ki ima sekundarni atom dušika na a-položaju. Ko je nitrozirana, nastane N-nitrozo (namesto diazo) spojina. odgovor:
a) 22,4 ml N2; b) 44,8 ml N2; c) ni sproščanja N 2. Naloga 2. Kot rezultat obdelave raztopine, ki vsebuje 9,36 mg neznane aminokisline, s presežkom dušikove kisline pri 748 mm Hg. in 20 °C smo dobili 2,01 ml dušika.
rešitev
Kaj je minimum

molska masa ta aminokislina? Reakcija aminokisline z dušikovo kislino: Kombinirana uporaba, izračunajmo prostornino dušika pri normalnih pogojih (pri temperaturi 0 ° C ali 273 ° K in tlaku 760 mm Hg): V 0 (N 2) (n.s.) = (P 1 · V 1 · T 0)/(P 0 ·T 1) = (748·2,01·273)/(760·293) = 1,84 ml.
Ker je število molov aminokislinske snovi in sproščenega plina N2 enako, bomo ustvarili razmerje:
9,36 mg aminokisline daje 1,84 ml N 2;
M (molekulska masa aminokisline) bo dala = 22,4 N 2.
M = (9,36·22,4)/1,84 = 114.
Lahko bi bil valin: 
Naloga 3.Živalski hemoglobin vsebuje 0,335 % železa (po teži). Kolikšna je najmanjša molska masa tega proteina? Koliko atomov železa je vključenih v molekulo, če je molekulska masa beljakovine, določena z merjenjem osmotskega tlaka, 67.000?
rešitev
Masni deležželezo v hemoglobinu: C%(Fe) = /M(protein), kjer je n število atomov Fe v proteinski molekuli. Naj bo n = 1, potem je M(protein)1 = M(Fe) 100%/C%(Fe) = 56 100/0,335 = 16700. Ker je prava vrednost (glede na pogoje) vira M(protein). = 67000, n = M vir/M 1 = 67000/16700 = 4.
Naloga 4. Med alkalno hidrolizo 48 g dipeptida, sestavljenega iz ostankov iste aminokisline, je nastala samo ena snov - natrijeva sol aminokisline. Masa te soli je 66,6 g. Ugotovite strukturo dipeptida.
rešitev
Reakcijska enačba za alkalno hidrolizo dipeptida je:
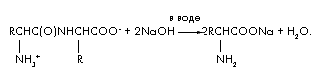
Označimo količino dipeptida v molih (dipeptid) = x. Nato reakcija hidrolize porabi dvakratno količino alkalije (NaOH) = 2x in proizvede (aminokisline) = 2x in (H2O) = x. Sestavimo enačbo materialna bilanca, z uporabo formule m = ·M;
m(dipeptid) + m(NaOH) = m(soli aminokislin) + m(H 2 O); 48 + 2x 40 = 66,6 + x 18; 62x = 18,6; ![]() .
.
x = 0,3 mol. M(dipeptid) = m/ = 48/0,3 = 160. M(aminokisline) = [M(dipeptid) + M(H 2 O)]/2 = 178/2 = 89 g/mol.
-
Aminokislina je alanin. Struktura dipeptida:
Sorodni članki
-
Učiteljevo razumevanje izkušenj srednješolcev Psihološko-pedagoška tehnologija etičnega dialoga kot sredstvo za vzpostavljanje medsebojnega razumevanja med dijaki in učitelji
"Mongolska invazija na Rusijo" - Razlogi za poraz ruskih čet. Mongoli. Džingiskan (1206-1227). Tatarsko-mongolska invazija. Leta 1241-1242 Mongolo-Tatari so opustošili Poljsko, Češko in Madžarsko. Batujeva prva akcija v severovzhodni Rusiji ...
-
Predstavitev na temo "značaj" Predstavitev na temo človeški značaj
Če želite uporabljati predogled predstavitev, ustvarite Google račun in se prijavite vanj: https://accounts.google.com Podnapisi diapozitivov: Značaj in temperament. Izvaja učitelj varnosti življenja MCOU "Naryshkinskaya Secondary School"...
-
Odkritja na dnu Marianskega jarka
V zemeljski skorji so globoke prelomnice - morske depresije na dnu oceanov, kjer vladata nepredirna tema in najvišji pritisk. Ponujamo izbor najglobljih morskih depresij, ki jih pomanjkanje...
-
Napoleon Bonaparte - vojne
Boji so bili predvsem posledica zavračanja Rusije, da bi aktivno podprla celinsko blokado, ki jo je Napoleon videl kot glavno orožje v boju proti Veliki Britaniji. Poleg tega je Bonaparte vodil politiko v...
-
Osnovne formule v fiziki – elektrika in magnetizem
Interakcije. Magnetna interakcija med železom in magnetom ali med magneti se ne pojavi le, ko sta v neposrednem stiku, ampak tudi na daljavo. Ko se razdalja povečuje, se interakcijska sila zmanjšuje in ...







