Glycine (กรดอะมิโนอะซิติก, ไกลโคคอล, Gly, G) คุณสมบัติทางเคมี เกลือโซเดียมของกรดอะมิโน
I. ตามจำนวนกลุ่มฟังก์ชัน
โมโนอะมิโนโมโน กรดคาร์บอกซิลิก
ตัวแทนที่ง่ายที่สุด:

กรดโมโนอะมิโนไดคาร์บอกซิลิก

ตัวอย่างเช่น:

กรดไดอะมิโนโมโนคาร์บอกซิลิก

ตัวอย่างเช่น:

ครั้งที่สอง โดย ตำแหน่งร่วมกันหมู่คาร์บอกซิลและอะมิโน
-α-กรดอะมิโน

- กรดอะมิโน

- กรดอะมิโน

สูตรและชื่อของกรด α-อะมิโนบางชนิด ซึ่งมีสารตกค้างเป็นส่วนหนึ่งของโปรตีน

โปรตีนเป็นโพลีเมอร์ตามธรรมชาติซึ่งมีการสร้างโมเลกุลขนาดใหญ่ขึ้นมา จำนวนมากสารตกค้างของกรด α-amino ที่แตกต่างกัน 20 ชนิด ในทางชีวเคมี ชื่อสั้นๆ เล็กๆ น้อยๆ และการกำหนดตัวอักษรสามตัวมักใช้สำหรับกรดอะมิโน
กรดโมโนอะมิโนโมโนคาร์บอกซิลิก
|
กรดอะมิโนเอทาโนอิกหรือกรดอะมิโนอะซิติกหรือไกลซีน (ไกลโคคอล) |
|
|
กรด 2-aminopropanoic หรือ α-aminopropionic หรืออะลานีน |
|
|
กรด 2-อะมิโน-3-ไฮดรอกซีโพรพาโนอิก หรือกรด α-อะมิโน-β-ไฮดรอกซีโพรพิโอนิก หรือซีรีน |
|
|
กรด 2-amino-3-mercaptopropanoic หรือ β-mercaptoalanine หรือ cysteine |
|
|
กรด 2-amino-3-phenylpropanoic หรือ β-phenylalanine หรือ phenylalanine |
|
|
2-อะมิโน-3-(4-ไฮดรอกซีฟีนิล)-กรดโพรพาโนอิก หรือ β-(n-ไฮดรอกซีฟีนิล)-อะปานีน หรือไทโรซีน |
|
|
กรด 2-อะมิโน-3-เมทิลบิวทาโนอิก หรือกรด α-อะมิโนไอโซวาเลอริก หรือวาลีน |
กรดโมโนอะมิโนไดคาร์บอกซิลิก
กรดไดมิโนโมโนคาร์บอกซิลิก
การจำแนกประเภทของกรดอะมิโนธรรมชาติ
I. กรดอะมิโนที่ทดแทนได้ - สามารถสังเคราะห์ได้ในร่างกายมนุษย์ สิ่งเหล่านี้รวมถึงสิ่งที่กล่าวมาข้างต้น: ไกลซีน, อะลานีน, ซีรีน, ซิสเทอีน, ไทโรซีน, กรดแอสปาร์ติกและกลูตามิก
ครั้งที่สอง กรดอะมิโนที่จำเป็นไม่สามารถสังเคราะห์ได้ในร่างกายมนุษย์และจะต้องถูกป้อนเข้าสู่ร่างกายโดยเป็นส่วนหนึ่งของโปรตีนในอาหาร ฟีนิลอะลานีน วาลีน ไลซีน เป็นตัวแทนของกรดอะมิโนที่จำเป็น
คุณสมบัติทางกายภาพ
กรดอะมิโนส่วนใหญ่ไม่มีสี สารที่เป็นผลึกละลายน้ำได้สูง กรดอะมิโนหลายชนิดมีรสหวาน จุดหลอมเหลวของกรดอะมิโนต่างๆ อยู่ระหว่าง 230-300°C
คุณสมบัติทางเคมี
กรดอะมิโนเป็นสารประกอบแอมโฟเทอริกซึ่งมีสาเหตุมาจากการมีอยู่ในโมเลกุลของกลุ่มฟังก์ชันที่มีลักษณะเป็นกรด (-COOH) และพื้นฐาน (-NH 2)
1. การโต้ตอบกับฐาน

2. ปฏิกิริยากับกรด

3. การก่อตัวของเกลือภายใน (ไอออนสองขั้ว)
ในสารละลายที่เป็นน้ำ กรดอะมิโนมีอยู่ในรูปของส่วนผสมสมดุลของโมเลกุลและไอออนไบโพลาร์ ซึ่ง สภาพแวดล้อมที่เป็นกรดเข้าสู่รูปประจุบวกและเข้า สภาพแวดล้อมที่เป็นด่าง- อยู่ในรูปประจุลบ
ก) กรดโมโนอะมิโนโมโนคาร์บอกซิลิก

เมื่อเกลือภายในของกรดโมโนอะมิโนโมโนคาร์บอกซิลิกเกิดขึ้น ลักษณะของตัวกลางจะไม่เปลี่ยนแปลง ดังนั้นกรดอะมิโนเหล่านี้จึงเรียกว่าเป็นกลาง ประจุรวมของเกลือภายในของกรดดังกล่าวคือศูนย์
เมื่อเติมกรด (H+) คาร์บอกซิเลทไอออนจะถูกโปรตอน เหลือเพียงประจุบวกบนหมู่ -NH
b) กรดโมโนอะมิโนไดคาร์บอกซิลิก

เมื่อเกลือภายในของกรดโมโนอะมิโนไดคาร์บอกซิลิกเกิดขึ้น จะเกิดไอออนไฮโดรเจนส่วนเกิน ดังนั้นสารละลายที่เป็นน้ำของกรดเหล่านี้จึงมีค่า pH
c) กรดไดอะมิโนโมโนคาร์บอกซิลิก

เมื่อเกลือภายในของกรดไดอะมิโนโมโนคาร์บอกซิลิกเกิดขึ้น ไอออนไฮดรอกไซด์ส่วนเกินจะเกิดขึ้น ดังนั้นสารละลายในน้ำจึงมี pH > 7 กรดอะมิโนดังกล่าวเรียกว่าเบส ประจุรวมของเกลือภายในของกรดอะมิโนพื้นฐานเป็นบวก
4. การสร้างเปปไทด์
เมื่อกลุ่มคาร์บอกซิลของโมเลกุลกรดอะมิโนหนึ่งทำปฏิกิริยากับกลุ่มอะมิโนของโมเลกุลกรดอะมิโนอื่น จะเกิดไดเปปไทด์:

เมื่อกรดอะมิโนสองชนิดทำปฏิกิริยากัน จะเกิดส่วนผสมของไดเปปไทด์สี่ชนิดขึ้น ตัวอย่างเช่น:

ไดเปปไทด์สามารถเพิ่มโมเลกุลของกรดอะมิโนอีกโมเลกุลเพื่อสร้างไตรเปปไทด์ ในทำนองเดียวกัน สามารถได้รับเตตราเปปไทด์จากไตรเปปไทด์ ฯลฯ
5. การก่อตัวของอนุพันธ์ที่กลุ่มคาร์บอกซิล
เช่นเดียวกับกรดคาร์บอกซิลิก กรดอะมิโนสามารถสร้างเอสเทอร์ กรดคลอไรด์ เป็นต้น ตัวอย่างเช่น

6. การควบแน่นของกรด ε-aminocaproic

วิธีการได้รับ
1. แอมโมไลซิสของกรดα-halocarboxylic
2. การย่อยโปรตีน
กรดอะมิโน – สิ่งเหล่านี้เป็นอนุพันธ์ของกรดอินทรีย์ที่มีกลุ่มอะมิโนตั้งแต่หนึ่งกลุ่มขึ้นไป (NH 2) ในอนุมูล
ตามระบบการตั้งชื่อที่มีเหตุผล ชื่อของพวกเขาจะมีคำนำหน้าว่า "อะมิโน" และตัวอักษรของอักษรกรีก (α-, β-, γ- ฯลฯ) ซึ่งบ่งบอกถึงตำแหน่งของหมู่อะมิโนที่สัมพันธ์กับหมู่คาร์บอกซิล
4-อะมิโนบิวเทน
(γ-อะมิโนบิวทีริก)
โปรตีนประกอบด้วยกรด α-อะมิโน ซึ่งได้รับชื่อที่ไม่สำคัญ
กรดอะมิโนแบ่งออกเป็น monoaminocarboxylic, diaminocarboxylic, aminodicarboxylic, อะโรมาติกและเฮเทอโรไซคลิก: CH 3 –CHNH 2 –COOH อะลานีน (กรดα-aminopropionic); กรดไดอะมิโนคาโปรอิก ); COOH–CH 2 –CHNH 2 –COOH กรดแอสปาร์ติก (กรดα-aminosuccinic); C 6 H 5 –CH 2 –CHNH 2 –COOH ฟีนิลอะลานีน (กรดα-amino-β-phenylpropionic);

(กรดไพร์โรลิดีน-α-คาร์บอกซิลิก)
กรด α-amino ทั้งหมดซึ่งมักพบในสิ่งมีชีวิตมีชื่อเล็กๆ น้อยๆ ซึ่งมักใช้ในวรรณคดี
คุณสมบัติของกรดอะมิโนกรดอะมิโนเป็นสารที่เป็นผลึก มักมีรสหวาน ละลายได้ง่ายในน้ำ
ขึ้นอยู่กับจำนวนของหมู่ฟังก์ชันอะมิโนหรือคาร์บอกซิลในกรดอะมิโน มันสามารถมีคุณสมบัติพื้นฐาน (ไลซีน) หรือคุณสมบัติเป็นกรด (กรดแอสปาร์ติก)
หมู่อะมิโนและหมู่คาร์บอกซิลสามารถสร้างไบโพลาร์ไอออนหรือเกลือภายในได้:
NH 2 –CH 2 –COOH →NH 3 + –CH 2 –COO –
การมีอยู่ของหมู่ –NH 2 และ –COOH ในกรดอะมิโนจะเป็นตัวกำหนดคุณสมบัติของแอมโฟเทอริก (พวกมันทำปฏิกิริยากับทั้งเบสและกรด)
H 2 N–CH 2 –COOH +NaOH→H 2 N–CH 2 –COONa+ H 2 O
เกลือโซเดียมไกลซีน
เอช 2 ยังไม่มีข้อความ–CH 2 –COOH +HCl→Cl –
เกลือไกลซีนไฮโดรคลอไรด์
กรดอะมิโนก่อให้เกิดเอสเทอร์กับแอลกอฮอล์
H 2 N–CH 2 –COOH + NOCH 3  NH 2 –CH 2 –COOCH 3 + H 2 O
NH 2 –CH 2 –COOCH 3 + H 2 O
ไกลซีน เมทิลเอสเตอร์
การก่อตัวของเกลือทองแดงในคอมเพล็กซ์เป็นลักษณะเฉพาะ ปฏิกิริยานี้สามารถใช้เพื่อแยกกรดอะมิโนได้

เกลือคอปเปอร์ไกลซีน
เมื่อถูกความร้อน กรด α-amino จะถูกแปลงเป็น 1,4-diketopiperazines

β  -กรดอะมิโนสูญเสียแอมโมเนียได้ง่ายเมื่อถูกความร้อน กลายเป็นกรดไม่อิ่มตัว
-กรดอะมิโนสูญเสียแอมโมเนียได้ง่ายเมื่อถูกความร้อน กลายเป็นกรดไม่อิ่มตัว
กรดอะคริลิก
กรดγ, δ, ε-กรดอะมิโนเมื่อถูกความร้อนจะถูกแปลงเป็นไซคลิกเอไมด์ - แลคแทม

ε-อะมิโนคาโปรอิก แอซิด คาโปรแลคตัม
ผลิตภัณฑ์ส่วนใหญ่ใช้ในการผลิตเส้นใยโพลีเอไมด์ - ไนลอน
กรดอะมิโนที่มีหมู่อะมิโนในตำแหน่ง α จะเกิดปฏิกิริยาขาดน้ำเพื่อสร้างโพลีเปปไทด์
ไกลซีน อะลานีน ซิสเทอีน
ชื่อของโพลีเปปไทด์ประกอบด้วยชื่อของอนุมูลกรดและชื่อเต็มของกรดที่ใช้เก็บหมู่คาร์บอกซิล
วิธีการได้รับกรดอะมิโนสามารถหาได้จากการไฮโดรไลซิสของโปรตีนหรือจากกรดฮาโลเจนภายใต้การกระทำของแอมโมเนีย:
อะลานีนของกรดα-โบรโมโพรพิโอนิก
กรด α-Amino เป็นส่วนหนึ่งขององค์ประกอบโปรตีนในอาหารและแบ่งออกเป็นประเภทที่ทดแทนได้และไม่สามารถทดแทนได้
กรดอะมิโนที่ไม่จำเป็นสามารถสังเคราะห์ได้จากร่างกายมนุษย์หรือสัตว์ กรดอะมิโนที่จำเป็น (เมไทโอนีน วาลีน ลิวซีน ฟีนิลอะลานีน ไอโซลิวซีน ทริปโตเฟน ไลซีน ทรีโอนีน) ไม่ได้ถูกสร้างขึ้นในสิ่งมีชีวิตและต้องได้รับอาหารเพื่อให้ทำงานได้ตามปกติ ตัวอย่างเช่น การขาดไลซีนส่งผลต่อการทำงานของเม็ดเลือดและการกลายเป็นปูนของกระดูก เมไทโอนีนมีฤทธิ์ต้านเกล็ดเลือด ทริปโตเฟนมีความสำคัญต่อกระบวนการเจริญเติบโตและการเผาผลาญ
แหล่งที่มาตามธรรมชาติของกรดα-อะมิโนคือสารโปรตีน (โดยการไฮโดรไลซิส)
กรดอะมิโนเป็นส่วนหนึ่งของพืช จุลินทรีย์ สัตว์ และมนุษย์ และมีบทบาทสำคัญในกระบวนการชีวิตของสิ่งมีชีวิต
กระรอก – เหล่านี้เป็นสารประกอบอินทรีย์ที่ประกอบด้วยไนโตรเจนโมเลกุลสูงตามธรรมชาติซึ่งโมเลกุลถูกสร้างขึ้นจากกรดα-อะมิโนที่เชื่อมโยงกันด้วยพันธะเปปไทด์นั่นคือโปรตีนคือโพลีเปปไทด์
สมดุล สมดุล สมดุล
อะลานีน ซีรีน ซีสเตอีน
โปรตีนมีการกระจายอย่างกว้างขวางในธรรมชาติ โดยเฉพาะในสัตว์และมนุษย์ ปริมาณมากโปรตีนพบได้ในกระดูก กระดูกอ่อน กล้ามเนื้อ และเนื้อเยื่อประสาท โปรตีนประกอบด้วยเส้นผม ขนสัตว์ ขนนก เกล็ดปลา กีบ เขา ฯลฯ โปรตีนพบได้ในไข่นกและเป็นส่วนหนึ่งของนม เลือด ฯลฯ เอนไซม์ ฮอร์โมน และไวรัสก็มีลักษณะเป็นโปรตีนเช่นกัน
โครงสร้างของโปรตีนโปรตีนทุกชนิดประกอบด้วยคาร์บอน ไฮโดรเจน ออกซิเจน ไนโตรเจน (ไม่ค่อยมี S, P, Fe)
น้ำหนักโมเลกุลของโปรตีนมีขนาดใหญ่มาก - ตั้งแต่ 5,000 ถึงหลายล้าน
เรียกว่าลำดับที่เรซิดิวของกรด α-อะมิโนในสายโซ่เชื่อมต่อกัน โครงสร้างหลักกระรอก. โปรตีนแต่ละประเภทมีเอกลักษณ์เฉพาะตัวอย่างเคร่งครัด
สายโพลีเปปไทด์มักมีรูปร่างเป็นเกลียว แนวโน้มของสายโซ่โพลีเปปไทด์ที่จะบิดเป็นเกลียวนั้นถูกกำหนดโดยโครงสร้างหลักของโปรตีน แต่ความแข็งแรงของมันถูกกำหนดโดยการก่อตัวของพันธะไฮโดรเจนระหว่างกลุ่ม  และ –NH– ของวงเลี้ยวที่อยู่ติดกันของเกลียว
และ –NH– ของวงเลี้ยวที่อยู่ติดกันของเกลียว
ตัวอย่างเช่น:

ลักษณะเฉพาะของการบิดโซ่โพลีเปปไทด์ของโมเลกุลโปรตีนให้เป็นเกลียวเรียกว่า โครงสร้างรองโปรตีน
การหมุนของเกลียวสามารถพับหรือโค้งงอได้ไม่ทางใดก็ทางหนึ่งเนื่องจากมีสะพานไดซัลไฟด์ –S–S– ซึ่งทำหน้าที่ยึดวงเลี้ยวบางวงในบริเวณใกล้เคียง พันธะไฮโดรเจน- จากการพับส่วนต่างๆ ของเกลียวนี้ รูปร่างของลูกบอลจึงถูกสร้างขึ้น โครงสร้างโปรตีนรูปแบบนี้เรียกว่า โครงสร้างระดับอุดมศึกษา
ในโมเลกุลของโปรตีนบางชนิดจะมีการสร้าง "ลูกบอล" (ทรงกลม) ดังกล่าวขึ้นหลายอันซึ่งเป็นผลมาจากการที่ โครงสร้างควอเทอร์นารีปรากฏขึ้นพันธะที่เชื่อมต่อหน่วยย่อยของโปรตีนเข้ากับโมเลกุลที่มีโครงสร้างควอเทอร์นารีนั้นไม่ใช่โควาเลนต์ แต่เป็นพันธะที่อ่อนกว่า เช่น ไฮโดรเจน (เช่นในโมเลกุลฮีโมโกลบิน) ปฏิกิริยาไอออนิกหรือที่เรียกว่าปฏิกิริยาที่ไม่ชอบน้ำ โปรตีนที่มีโครงสร้างควอเทอร์นารีเนื่องจากความเปราะบางของพันธะที่เชื่อมต่อหน่วยย่อย มีความสามารถในการแยกตัวออกเป็นหน่วยย่อยแบบย้อนกลับได้ ในกรณีนี้กิจกรรมของเอนไซม์ของโปรตีนอาจหายไป
การจำแนกประเภทของโปรตีนโปรตีนแบ่งออกเป็นสองกลุ่มหลัก: โปรตีน (โปรตีนเชิงเดี่ยว) และโปรตีน (โปรตีนเชิงซ้อน) โปรตีนประกอบด้วยกรดอะมิโนเท่านั้นและไม่ก่อให้เกิดผลิตภัณฑ์อื่นหลังจากการไฮโดรไลซิส โปรตีนประกอบด้วยส่วนโปรตีนที่สร้างจากกรด α-อะมิโน และส่วนที่ไม่ใช่โปรตีน (กลุ่มเทียม) ในระหว่างการไฮโดรไลซิส โปรตีนเหล่านี้นอกเหนือจากกรด α-อะมิโน ยังให้สารอื่นๆ ด้วย เช่น คาร์โบไฮเดรต กรดฟอสฟอริก สารประกอบเฮเทอโรไซคลิก สีย้อม ฯลฯ
ไปจนถึงโปรตีน หมายถึงโปรตีนเชิงเดี่ยวจำนวนหนึ่งซึ่งมีความสามารถในการละลายต่างกันในตัวทำละลายต่างกัน
อัลบูมิน –โปรตีนที่ละลายน้ำได้จะไม่ตกตะกอนด้วยสารละลายโซเดียมคลอไรด์อิ่มตัว แต่จะตกตะกอนด้วยสารละลายแอมโมเนียมซัลเฟตอิ่มตัวและจับตัวเป็นก้อนเมื่อถูกความร้อน ตัวแทน: อัลบูมินของไข่, นม, ซีรั่มในเลือด, โปรตีนของเอนไซม์และเมล็ดพืช
โกลบูลิน –โปรตีนที่ไม่ละลายในน้ำ แต่ละลายได้ในสารละลายเกลือเจือจาง จับตัวเป็นก้อนเมื่อถูกความร้อน มีน้ำหนักโมเลกุลสูงกว่าอัลบูมิน ตัวแทน: โกลบูลินนม, ไข่, เลือด, โปรตีนจากกล้ามเนื้อ (ไมโอซิน), เมล็ดพืช
โปรลามิน –โปรตีนที่ละลายได้ในแอลกอฮอล์ 70–80% ไม่ละลายในน้ำและแอลกอฮอล์ปราศจากน้ำ พวกเขาไม่จับตัวเป็นก้อนเมื่อเดือด ตัวแทน: โปรตีนจากธัญพืช (gliadin - ในข้าวสาลี, zein - ในข้าวโพด)
กลูเตลิน –โปรตีนจากพืชที่ไม่ละลายในสารละลายเกลือที่เป็นกลางและใน เอทิลแอลกอฮอล์- ละลายในสารละลายอัลคาไลเจือจาง (0.2%) เท่านั้น มีอยู่ในเมล็ดธัญพืชเป็นหลัก กลูเตลินในธัญพืชบางชนิดเรียกว่ากลูเตนิน (มาจากคำว่า กลูเตน)
ฮิสโตนส์ –โปรตีนที่มีลักษณะพื้นฐานเนื่องจากมีกรดไดอะมิโนจำนวนมาก ละลายได้ในน้ำและกรดเจือจาง แต่ไม่ละลายในด่างเจือจาง มักจะเป็นตัวแทนของส่วนโปรตีนของโปรตีนเชิงซ้อน ตัวแทน: โกลบินเป็นโปรตีนที่เป็นส่วนหนึ่งของฮีโมโกลบิน
โปรตามีน –โปรตีนธรรมชาติที่ง่ายที่สุดที่มีน้ำหนักโมเลกุลต่ำ ประกอบด้วยกรดไดอะมิโนเป็นส่วนใหญ่และเป็นเบสแก่ ละลายได้ดีในน้ำ กรดเจือจาง และด่าง อย่าจับตัวเป็นก้อนเมื่อถูกความร้อน ตัวแทนของโปรทามีนพบได้ในอสุจิของปลาซึ่งเป็นส่วนหนึ่งของโปรตีนเชิงซ้อน - นิวคลีโอโปรตีน
อัลบูมินอยด์(scleroproteins) เป็นโปรตีนที่มีคุณสมบัติแตกต่างอย่างมากจากโปรตีนชนิดอื่น พวกมันละลายเฉพาะเมื่อมีการบำบัดเป็นเวลานานด้วยกรดและด่างเข้มข้นพร้อมกับการแยกโมเลกุล ในสิ่งมีชีวิตของสัตว์ พวกมันทำหน้าที่สนับสนุนและทำหน้าที่เกี่ยวกับผิวหนัง แต่ไม่พบในพืช ตัวแทนของ scleroproteins ได้แก่ ไฟโบรอิน - โปรตีนไหม; เคราติน - โปรตีนของเส้นผม, ขนสัตว์, สารมีเขา, หนังกำพร้าของผิวหนัง; อีลาสตินเป็นโปรตีนในผนังหลอดเลือดและเส้นเอ็น คอลลาเจนเป็นสารโปรตีนของผิวหนัง กระดูก กระดูกอ่อน และเนื้อเยื่อเกี่ยวพัน
โปรตีน – โปรตีนเชิงซ้อนแบ่งออกเป็นกลุ่มย่อยขึ้นอยู่กับลักษณะของส่วนเทียม (ไม่ใช่โปรตีน)
ฟอสโฟโปรตีน –โปรตีนที่มีกรดฟอสฟอริกตกค้างเป็นกลุ่มเทียม ตัวแทน: เคซีน - โปรตีนนม, ไวเทลลิน - โปรตีนที่พบในไข่แดงของไข่ไก่
นิวคลีโอโปรตีน –โปรตีนซึ่งส่วนโปรตีนนั้นเกี่ยวข้องด้วย กรดนิวคลีอิกและอย่างหลังเมื่อไฮโดรไลซิสเกิดกรดฟอสฟอริก สารประกอบเฮเทอโรไซคลิก และคาร์โบไฮเดรต นิวคลีโอโปรตีนเป็นส่วนหนึ่งของนิวเคลียสของเซลล์พืชและสัตว์
โครโมโปรตีน –สารที่ส่วนโปรตีนรวมกับสารแต่งสี ตัวแทน: เฮโมโกลบินในเลือด ในระหว่างการไฮโดรไลซิสมันจะสลายตัวสร้างโปรตีนโกลบินและสารสี - ฮีม
กลูโคโปรตีน –โปรตีนที่ส่วนโปรตีนรวมกับคาร์โบไฮเดรต ตัวแทน: เมือกซึ่งเป็นส่วนหนึ่งของน้ำลาย
ไลโปโปรตีน –การเชื่อมต่อของโปรตีนกับไขมัน อย่างหลังได้แก่ไขมัน ฟอสฟาไทด์ เป็นต้น ไลโปโปรตีนพบได้ในโปรโตพลาสซึมของเซลล์ ในซีรั่มในเลือด และในไข่แดง
สารโปรตีนยังจำแนกตามรูปร่างของโมเลกุลโดยแบ่งออกเป็นสองกลุ่ม:
ก) โปรตีนไฟบริลลาร์ (เส้นใย) โมเลกุลที่มีรูปร่างเป็นใย เหล่านี้รวมถึงไฟโบรอินไหม, เคราตินขนแกะ, ไมโอซินของกล้ามเนื้อ;
b) โปรตีนทรงกลมซึ่งมีโมเลกุลที่มีรูปร่างกลม ซึ่งรวมถึงอัลบูมิน โกลบูลิน และโปรตีนเชิงซ้อนอีกจำนวนหนึ่ง
คุณค่าทางโภชนาการของโปรตีนนั้นพิจารณาจากองค์ประกอบเชิงคุณภาพและเชิงปริมาณของกรดอะมิโนที่มีอยู่ มีโปรตีนที่สมบูรณ์และไม่สมบูรณ์
โปรตีนสมบูรณ์ประกอบด้วยกรดอะมิโนที่จำเป็นทั้งหมด (เคซีนนม อัลบูมินไข่ โปรตีนจากเนื้อสัตว์)
โปรตีนที่ไม่สมบูรณ์คือโปรตีนที่ไม่มีกรดอะมิโนที่จำเป็นอย่างน้อยหนึ่งชนิด (คอร์นซีอิน เจลาติน)
คุณสมบัติของโปรตีนสารโปรตีนมีความหลากหลายในสถานะการรวมตัว มักเป็นสารอสัณฐานแข็งที่มีลักษณะเป็นผงสีขาว โปรตีนจากขนสัตว์ (เคราติน) และไหม (ไฟโบรอิน) เป็นเส้นใยที่แข็งแรง โปรตีนบางชนิดได้มาในสถานะผลึก (ฮีโมโกลบินในเลือด) หลายชนิดมีความคงตัวของของเหลวหรือเยลลี่ที่มีความหนืด
โปรตีนทั้งหมดไม่ละลายในแอลกอฮอล์ปราศจากน้ำและตัวทำละลายอินทรีย์อื่นๆ โปรตีนหลายชนิดละลายในน้ำและในสารละลายเกลือเจือจาง แต่ก่อตัวไม่เป็นความจริง แต่เป็นสารละลายคอลลอยด์ มีโปรตีนที่ไม่ละลายในน้ำอย่างสมบูรณ์
สารละลายของโปรตีนธรรมชาตินั้นมีฤทธิ์ทางแสง (ส่วนใหญ่มีการหมุนทางซ้าย)
โปรตีน เช่น กรดอะมิโน เป็นแอมโฟเทอริกและสร้างเกลือที่มีทั้งกรดและเบส:
H 3 N + –R–COO – + H + + Cl –  NH 3 + –R–COOH + Сl – ;
NH 3 + –R–COOH + Сl – ;
H 3 N + –R–COO – + นา + + OH –  NH 2 –R–COO – + Na + + H 2 O.
NH 2 –R–COO – + Na + + H 2 O.
ในที่ที่มีกรด โมเลกุลโปรตีนจะมีประจุบวก และในระหว่างอิเล็กโทรไลซิสจะเคลื่อนที่ไปที่แคโทด เมื่อมีด่าง โมเลกุลโปรตีนจะมีประจุลบและเคลื่อนที่ไปยังขั้วบวก ที่ค่า pH ที่กำหนด สารละลายจะมีโปรตีนแคตไอออนและแอนไอออนในปริมาณขั้นต่ำ ภายใต้เงื่อนไขเหล่านี้การเคลื่อนที่ของโมเลกุลโปรตีนระหว่างอิเล็กโทรโฟรีซิสจะไม่เกิดขึ้น ค่า pH ของสารละลายที่สารละลายโปรตีนประกอบด้วยแคตไอออนและแอนไอออนในปริมาณขั้นต่ำเรียกว่า จุดไอโซอิเล็กทริกสำหรับโปรตีนชนิดต่างๆ ค่าของจุดไอโซอิเล็กทริกจะไม่เท่ากัน ตัวอย่างเช่น สำหรับไข่ขาว (อัลบูมิน) จุดไอโซอิเล็กทริกอยู่ที่ pH = 4.8 สำหรับโปรตีนข้าวสาลี (ไกลาดิน) - ที่ pH = 9.8
โปรตีนทุกชนิดมีคุณสมบัติร่วมกันบางประการ ได้แก่ ปฏิกิริยาการตกตะกอนจากสารละลายและปฏิกิริยาสี
การตกตะกอนของโปรตีนจากสารละลายเมื่อเพิ่มเข้าไปแล้ว สารละลายที่เป็นน้ำโปรตีนจากสารละลายเกลือแร่เข้มข้น (เช่น (NH 4) 2 SO 4) โปรตีนจะตกตะกอน แอลกอฮอล์และอะซิโตนมีผลคล้ายกันกับโปรตีน ในกรณีทั้งหมดนี้ โปรตีนจะไม่เปลี่ยนคุณสมบัติ และเมื่อเจือจางด้วยน้ำ ก็จะกลับคืนสู่สารละลาย กระบวนการนี้เรียกว่า เกลือออก
เมื่อถูกความร้อน โปรตีนจำนวนมากจะจับตัวเป็นก้อน (เช่น ไข่ขาว) และยังตกตะกอนจากสารละลาย แต่จะสูญเสียความสามารถในการละลายในน้ำ ในกรณีนี้จะมีการเปลี่ยนแปลงคุณสมบัติของโปรตีนอย่างมีนัยสำคัญ กระบวนการตกตะกอนของโปรตีนที่ไม่สามารถย้อนกลับได้นี้เรียกว่า การเสียสภาพการเสียสภาพอาจเกิดจากเกลือของโลหะหนัก (CuSO 4, Pb(CH 3 COO) 2, HgCl ฯลฯ), กรดเข้มข้น (HNO 3, H 2 SO 4, CH 3 COOH, พิคริก, คลอโรอะซิติก), ด่างกัดกร่อน ( KOH, NaOH), ฟีนอล, ฟอร์มาลิน, แทนนิน ฯลฯ
การสูญเสียโปรตีนยังเกิดจากรังสีประเภทต่างๆ (อัลตราไวโอเลต กัมมันตภาพรังสี ฯลฯ) ในระหว่างการเสื่อมสภาพ โครงสร้างควอเทอร์นารี ตติยภูมิ และทุติยภูมิจะถูกทำลาย โดยปกติโครงสร้างหลักจะยังคงอยู่นั่นคือการทำลายพันธะเปปไทด์จะไม่เกิดขึ้น โครงสร้างหลักของโปรตีนจะถูกทำลายในระหว่างการไฮโดรไลซิสของโปรตีน ซึ่งเกิดขึ้นระหว่างการย่อยอาหารที่มีโปรตีน ในระบบทางเดินอาหารภายใต้การทำงานของเอนไซม์ โปรตีนในอาหารจะถูกย่อยสลายผ่านผลิตภัณฑ์ขั้นกลางหลายชุดให้เป็นกรดอะมิโน จากการรวมตัวของกรดอะมิโนที่ได้รับ ร่างกายจะสร้างโปรตีนตามที่ต้องการ โปรตีนตกค้างที่ไม่ได้ใช้จะถูกย่อยสลายเป็นสารประกอบที่ง่ายกว่าและถูกขับออกจากร่างกาย
ปฏิกิริยาสีของโปรตีน
1. ปฏิกิริยาไบยูเรต
เมื่อทำปฏิกิริยากับเกลือทองแดง (CuSO 4) ในตัวกลางที่เป็นด่าง โปรตีนทั้งหมดจะให้สีม่วง ปฏิกิริยานี้เป็นปฏิกิริยาเชิงคุณภาพ พันธะเปปไทด์และยืนยันการมีอยู่ของโปรตีนและโพลีเปปไทด์ สำหรับโพลีเปปไทด์ที่แตกต่างกัน สีที่ปรากฏขึ้นเมื่อทำปฏิกิริยากับเกลือของทองแดงจะไม่เหมือนกัน: ไดเปปไทด์ให้สีฟ้า, ไตรเปปไทด์ให้สีม่วง และโพลีเปปไทด์ที่ซับซ้อนกว่าให้สีแดง
2. ปฏิกิริยาแซนโทโปรตีน
เมื่อสารละลายโปรตีนถูกให้ความร้อนด้วยกรดไนตริกเข้มข้น (HNO 3) สารละลายจะเปลี่ยนเป็นสีเหลือง ปฏิกิริยานี้อธิบายได้จากการมีอยู่ของโปรตีนของกรดอะมิโนที่มีอนุมูลอะโรมาติกไฮโดรคาร์บอน (C 6 H 5 –) ซึ่งเมื่อทำปฏิกิริยากับ กรดไนตริกกลายเป็นสารประกอบไนโตรที่มีสีเหลือง
3. ปฏิกิริยาซีสตีน (ซัลไฮดริล)
หากคุณต้มสารละลายโปรตีนที่มีโซเดียมไฮดรอกไซด์มากเกินไปและเติมสารละลายตะกั่วอะซิเตต Pb(CH 3 COO) 2 ลงไปสองสามหยด จะมีสีน้ำตาลดำหรือตะกอนปรากฏขึ้น
โปรตีน + NaOH  Na 2 S+ สารอื่นๆ
Na 2 S+ สารอื่นๆ
นา 2 S + Pb(CH 3 COO) 2 → PbS↓ + 2CH 3 COONa
ปฏิกิริยานี้เป็นการยืนยันว่ามีกำมะถันที่จับตัวอย่างอ่อนอยู่ในโปรตีน
มีปฏิกิริยาเชิงคุณภาพอื่นๆ อีกหลายประการต่อโปรตีน
ความหมายและการใช้โปรตีนโปรตีนเป็นส่วนประกอบที่สำคัญที่สุดของผลิตภัณฑ์อาหาร โปรตีนมากกว่า 50% ในอาหารของมนุษย์ควรเป็นโปรตีนจากสัตว์ ผู้ใหญ่ต้องการโปรตีน 80–100 กรัมต่อวัน และเมื่อมีการออกกำลังกายอย่างหนัก - 120 กรัมขึ้นไป
สารโปรตีนมีการใช้กันอย่างแพร่หลายในการผลิตสินค้าอุตสาหกรรม (หนัง ขนสัตว์ ขนสัตว์ ผ้าไหม) ในการผลิตกาว เจลาติน พลาสติก (กาลาไลต์) ขนสัตว์เทียม สำหรับการเตรียมอิมัลชันไวแสงในอุตสาหกรรมภาพถ่าย ฯลฯ
มากมาย ยามีลักษณะของโปรตีน (อินซูลิน, ตับอ่อน, ฯลฯ ) ควรให้ความสนใจเป็นพิเศษกับตัวเร่งปฏิกิริยาทางชีวภาพ - เอนไซม์ซึ่งเป็นสารโปรตีนด้วย มักปรากฏในปริมาณเพียงเล็กน้อยเท่านั้น ซึ่งมีส่วนทำให้เกิดการเปลี่ยนแปลงทางเคมีอย่างรวดเร็วของสารต่างๆ ในปริมาณมหาศาลภายใต้สภาวะที่ไม่รุนแรงมาก (อุณหภูมิต่ำ ฯลฯ)
ไวรัสและแบคทีเรียก็มีลักษณะเป็นโปรตีนเช่นกัน ดังนั้นเมื่อเก็บรักษาผลิตภัณฑ์อาหารและรักษาโรคต่าง ๆ จึงมีการใช้ยาที่ทำลายสารโปรตีน (กรดซาลิไซลิก, แอสไพริน, ซาโลล, แทนนิน, โพลีฟีนอลต่างๆ, กรดอะซิติก ฯลฯ )
โปรตีนเป็นสารที่จำเป็นอย่างยิ่งต่อชีวิตของสัตว์ พืช และจุลินทรีย์ ชีวิตนั้นเป็นกระบวนการของการเปลี่ยนแปลงที่ซับซ้อนของสารโปรตีน
Glycine (กรดอะมิโนอะซิติก, ไกลโคคอล, Gly, G)
H2NCH2COOH
น้ำหนักโมเลกุล 75.07; ผลึกไม่มีสี ไม่ละลาย 232-236°C (มีการสลายตัว); ละลายได้ในน้ำ ไม่ละลายในตัวทำละลายอินทรีย์ส่วนใหญ่ ที่ 25°C หน้า เค 2.34 (COOH) และ 9.6 (NH 2); ร ฉัน 5,97.
ในแง่ของคุณสมบัติทางเคมี ไกลซีนเป็นกรดอะลิฟาติก α-อะมิโนทั่วไป การกำหนดเชิงปริมาณขึ้นอยู่กับการก่อตัวของผลิตภัณฑ์ที่มีสีด้วยโอ-พทาลาลดีไฮด์ (ปฏิกิริยาซิมเมอร์มันน์) พบบ่อยในโปรตีนมากกว่ากรดอะมิโนอื่นๆ ทำหน้าที่เป็นสารตั้งต้นในการสังเคราะห์ทางชีวภาพของสารประกอบพอร์ไฟรินและเบสพิวรีน Glycine เป็นกรดอะมิโนที่มีรหัสซึ่งไม่จำเป็น การสังเคราะห์ทางชีวภาพนั้นดำเนินการโดยการปนเปื้อนของกรดไกลออกซิลิก, ความแตกแยกของเอนไซม์ของซีรีนและทรีโอนีน ไลซีนสังเคราะห์ได้จากกรดคลอโรอะซิติกและ NH 3 ในสเปกตรัม NMR ใน D 2 O การเปลี่ยนแปลงทางเคมีของโปรตอนของกลุ่ม CH 2 คือ 3.55 ppm เกลือภายในของไกลซีน (CH 3) 3 + NCH 2 COO เรียกว่าเบทาอีน
Glycine ใช้สำหรับการสังเคราะห์เปปไทด์ซึ่งเป็นส่วนประกอบของสารละลายบัฟเฟอร์ในการผสมกับกรดอะมิโนอื่น ๆ - สำหรับสารอาหารทางหลอดเลือด
โครมาโตแกรมของตัวอย่างที่มีสารนี้
กรดอะมิโนเป็นสารประกอบแอมโฟเทริกอินทรีย์ ประกอบด้วยหมู่ฟังก์ชัน 2 หมู่ที่มีลักษณะตรงกันข้ามกันในโมเลกุล ได้แก่ หมู่อะมิโนที่มีคุณสมบัติพื้นฐาน และหมู่คาร์บอกซิลที่มีคุณสมบัติเป็นกรด กรดอะมิโนทำปฏิกิริยากับทั้งกรดและเบส:
H 2 N -CH 2 -COOH + HCl → Cl [H 3 N-CH 2 -COOH],
H 2 N -CH 2 -COOH + NaOH → H 2 N-CH 2 -COONa + H 2 O
เมื่อกรดอะมิโนละลายในน้ำ หมู่คาร์บอกซิลจะกำจัดไฮโดรเจนไอออน ซึ่งสามารถเกาะติดกับหมู่อะมิโนได้ ในกรณีนี้เกลือภายในจะเกิดขึ้นซึ่งมีโมเลกุลเป็นไอออนสองขั้ว:
H 2 N-CH 2 -COOH + H 3 N -CH 2 -COO - .
การแปลงกรด-เบสของกรดอะมิโนเป็น สภาพแวดล้อมที่แตกต่างกันสามารถแสดงได้ด้วยแผนภาพทั่วไปดังต่อไปนี้:

สารละลายที่เป็นน้ำของกรดอะมิโนมีสภาพแวดล้อมที่เป็นกลาง เป็นด่างหรือเป็นกรด ขึ้นอยู่กับจำนวนหมู่ฟังก์ชัน ดังนั้นกรดกลูตามิกจึงเกิดสารละลายที่เป็นกรด (กลุ่ม -COOH สองกลุ่ม, หนึ่งกลุ่ม -NH 2) ไลซีนจึงเกิดสารละลายด่าง (กลุ่ม -COOH หนึ่งกลุ่ม, สองกลุ่ม -NH 2)
เช่นเดียวกับเอมีนปฐมภูมิ กรดอะมิโนทำปฏิกิริยากับกรดไนตรัส โดยหมู่อะมิโนถูกแปลงเป็นกลุ่มไฮดรอกโซ และกรดอะมิโนเป็นกรดไฮดรอกซี:
H 2 N-CH(R)-COOH + HNO 2 → HO-CH(R)-COOH + N 2 + H 2 O
การวัดปริมาตรของไนโตรเจนที่ปล่อยออกมาช่วยให้เราสามารถกำหนดปริมาณกรดอะมิโนได้ ( วิธีการของแวน สไลค์).
กรดอะมิโนสามารถทำปฏิกิริยากับแอลกอฮอล์เมื่อมีก๊าซไฮโดรเจนคลอไรด์เปลี่ยนเป็น เอสเทอร์(แม่นยำยิ่งขึ้นในเกลือไฮโดรคลอไรด์ของอีเทอร์):
H 2 N-CH(R)-COOH + R'OH H 2 N-CH(R)-COOR' + H 2 O
กรดอะมิโนเอสเทอร์ไม่มีโครงสร้างแบบไบโพลาร์และเป็นสารประกอบระเหยได้
คุณสมบัติที่สำคัญที่สุดของกรดอะมิโนคือความสามารถในการควบแน่นเพื่อสร้างเปปไทด์
ปฏิกิริยาเชิงคุณภาพ.
1) กรดอะมิโนทั้งหมดถูกออกซิไดซ์โดยนินไฮดริน

ด้วยการก่อตัวของผลิตภัณฑ์ที่มีสีเข้า สีฟ้าม่วง- โพรลีนของกรดอิมิโนให้สีเหลืองพร้อมกับนินไฮดริน ปฏิกิริยานี้สามารถใช้เพื่อวัดปริมาณกรดอะมิโนโดยสเปกโตรโฟโตเมทรี
2) เมื่อกรดอะมิโนอะโรมาติกถูกให้ความร้อนด้วยกรดไนตริกเข้มข้น จะเกิดไนเตรชันของวงแหวนเบนซีนและสารประกอบจะมีสี สีเหลือง- ปฏิกิริยานี้เรียกว่า แซนโทโปรตีน(จากภาษากรีก xanthos - สีเหลือง)
โปรตีนเป็นโพลีเปปไทด์ที่มีน้ำหนักโมเลกุลค่อนข้างใหญ่ซึ่งมีโครงสร้างเชิงพื้นที่ที่แน่นอนซึ่งขึ้นอยู่กับลำดับของกรดอะมิโนที่รวมอยู่ในสายโซ่โปรตีน โครงสร้างนี้อาจมีขนาดกะทัดรัด (โปรตีนทรงกลม) หรือยาว (โปรตีนไฟบริลลาร์) เอนไซม์ทั้งหมดเป็นโปรตีนทรงกลม โปรตีนไฟบริลลาร์ ได้แก่ คอลลาเจน เคราติน ซึ่งเป็นโปรตีนของผิวหนังและเส้นผม มีความแข็งแรงมากและขยายตัวได้สูง
ขึ้นอยู่กับองค์ประกอบโปรตีนจะถูกแบ่งออกเป็นแบบง่าย ๆ ประกอบด้วยกรดอะมิโนเท่านั้นและโปรตีนเชิงซ้อน - เชิงซ้อนหรือ สารประกอบโควาเลนต์โพลีเปปไทด์ที่มีโมเลกุลประเภทอื่น:
กรดนิวคลีอิก – นิวคลีโอโปรตีน;
โพลีแซ็กคาไรด์ - ไกลโคโปรตีน;
ไขมัน – ไลโปโปรตีน;
เม็ดสี – โครโมโปรตีน;
กรดฟอสฟอริกตกค้าง - ฟอสโฟโปรตีน
ส่วนโปรตีนของโปรตีนเชิงซ้อนเรียกว่า อะพอลโลคอม, ไม่ใช่โปรตีน – กลุ่มขาเทียม- โปรตีนทรงกลมที่เรียบง่ายและซับซ้อนเกือบทั้งหมดเป็นเอนไซม์ซึ่งเป็นตัวเร่งปฏิกิริยาทางชีวภาพของปฏิกิริยาทางชีวเคมีในสิ่งมีชีวิต
งาน
ภารกิจที่ 1ก๊าซจะมีปริมาตรเท่าไร (ภายใต้สภาวะปกติ) จะถูกปล่อยออกมาระหว่างการทำปฏิกิริยากับ กรดไนตรัสกรดอะมิโน 0.001 โมล: ก) ลิวซีน; b) ไลซีน; c) โพรลีน?
สารละลาย
ให้เราเขียนสมการสำหรับปฏิกิริยาของกรดอะมิโนที่อยู่ในรายการกับกรดไนตรัส
ในกรณีของลิวซีนและไลซีน การปนเปื้อนจะเกิดขึ้นตาม Van Slyke และสำหรับไลซีน - บนกลุ่มอะมิโนสองกลุ่มที่มีอยู่ในโมเลกุล โพรลีนไม่มีหมู่อะมิโนหลัก ดังนั้นกระบวนการนี้จึงหยุดที่ระยะ N-ไนโตรเซชัน ในปฏิกิริยา (a) จำนวนโมลของลิวซีน n(Leu) เท่ากับจำนวนโมลของไนโตรเจนที่ปล่อยออกมา n(N2) ดังนั้น 0.001 โมลหรือไนโตรเจน 22.4 มิลลิลิตรจึงถูกปลดปล่อย ในปฏิกิริยา (b)
ก๊าซ 2n(N 2) จำนวนสองเท่าจะเกิดขึ้นเมื่อเทียบกับ n(lys) เนื่องจากกรดอะมิโนดั้งเดิมมีกลุ่มอะมิโนหลักสองกลุ่ม ปริมาตรไนโตรเจนที่ปล่อยออกมาจะอยู่ที่ 44.8 มล. ในปฏิกิริยา (c) ไนโตรเจนจะไม่ถูกปล่อยออกมา โพรลีนเป็นกรดอะมิโนจำเป็นเพียงชนิดเดียวจาก 20 ชนิดที่มีอะตอมไนโตรเจนรองอยู่ในตำแหน่ง a เมื่อไนโตรเซตจะเกิดสารประกอบ N-nitroso (แทนที่จะเป็นไดโซ)คำตอบ:
ก) 22.4 มล. ยังไม่มีข้อความ 2;ข) 44.8 มล. ยังไม่มีข้อความ 2; c) ไม่มีการปลดปล่อย N 2 ภารกิจที่ 2อันเป็นผลมาจากการบำบัดสารละลายที่ประกอบด้วยกรดอะมิโนที่ไม่รู้จัก 9.36 มก. โดยมีกรดไนตรัสมากเกินไปที่ 748 มม. ปรอท และ 20 °C ได้ไนโตรเจน 2.01 มล.
สารละลาย
ขั้นต่ำคืออะไร

มวลฟันกราม กรดอะมิโนนี่เหรอ?ปฏิกิริยาของกรดอะมิโนกับกรดไนตรัส: โดยใช้รวมกันลองคำนวณปริมาตรไนโตรเจนภายใต้สภาวะปกติ (ที่อุณหภูมิ 0 ° C หรือ 273 ° K และความดัน 760 มม. ปรอท): V 0 (N 2) (n.s.) = (P 1 · V 1 · T 0)/(P 0 ·T 1) = (748·2.01·273)/(760·293) = 1.84 มล.
เนื่องจากจำนวนโมลของสารกรดอะมิโนและก๊าซที่พัฒนาแล้ว N2 เท่ากัน เราจะสร้างสัดส่วน:
กรดอะมิโน 9.36 มก. ให้ N 2 1.84 มล.
M (น้ำหนักโมเลกุลของกรดอะมิโน) จะให้ = 22.4 N 2
ม = (9.36·22.4)/1.84 = 114
อาจเป็นวาลีน: 
ภารกิจที่ 3เฮโมโกลบินในสัตว์มีธาตุเหล็ก 0.335% (โดยน้ำหนัก) โปรตีนนี้มีมวลโมลขั้นต่ำคือเท่าใด? อะตอมของเหล็กจะรวมอยู่ในโมเลกุลจำนวนเท่าใด หากน้ำหนักโมเลกุลของโปรตีนซึ่งกำหนดโดยการวัดความดันออสโมติกคือ 67,000
สารละลาย
เศษส่วนมวลเหล็กในเฮโมโกลบิน: C%(Fe) = /M(โปรตีน) โดยที่ n คือจำนวนอะตอมของ Fe ในโมเลกุลโปรตีน ให้ n = 1 จากนั้น M(โปรตีน)1 = M(Fe) 100%/C%(Fe) = 56 100/0.335 = 16700 เนื่องจากค่าจริง (ตามเงื่อนไข) ของแหล่งกำเนิด M(โปรตีน) = 67000, n = แหล่ง M/M 1 = 67000/16700 = 4
ภารกิจที่ 4ในระหว่างการไฮโดรไลซิสอัลคาไลน์ของไดเปปไทด์ 48 กรัมซึ่งประกอบด้วยสารตกค้างของกรดอะมิโนชนิดเดียวกันจะมีการสร้างสารเพียงชนิดเดียวเท่านั้นนั่นคือเกลือโซเดียมของกรดอะมิโน มวลของเกลือนี้คือ 66.6 กรัม สร้างโครงสร้างของไดเปปไทด์
สารละลาย
สมการปฏิกิริยาสำหรับการไฮโดรไลซิสแบบอัลคาไลน์ของไดเปปไทด์คือ:
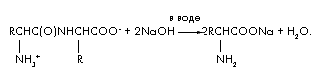
ให้เราแสดงปริมาณไดเปปไทด์ในหน่วยโมล (ไดเปปไทด์) = x จากนั้นปฏิกิริยาไฮโดรไลซิสจะใช้ปริมาณอัลคาไล (NaOH) = 2x สองเท่าและทำให้เกิด (กรดอะมิโน) = 2x และ (H2O) = x มาสร้างสมการกันเถอะ ความสมดุลของวัสดุโดยใช้สูตร m = ·M;
ม.(ไดเปปไทด์) + ม.(NaOH) = ม.(เกลือของกรดอะมิโน) + ม.(H 2 O); 48 + 2x 40 = 66.6 + x 18; 62x = 18.6; ![]() .
.
x = 0.3 โมล M(ไดเปปไทด์) = m/ = 48/0.3 = 160 M(กรดอะมิโน) = [M(ไดเปปไทด์) + M(H 2 O)]/2 = 178/2 = 89 กรัม/โมล
-
กรดอะมิโนคืออะลานีน โครงสร้างไดเปปไทด์:
บทความที่เกี่ยวข้อง
-
ความเข้าใจของครูเกี่ยวกับประสบการณ์ของนักเรียนมัธยมปลาย เทคโนโลยีทางจิตวิทยาและการสอนของบทสนทนาเชิงจริยธรรมอันเป็นวิธีการสร้างความเข้าใจร่วมกันระหว่างนักเรียนมัธยมปลายและครู
“ การรุกรานของมองโกลมาตุภูมิ” - สาเหตุของความพ่ายแพ้ของกองทหารรัสเซีย ชาวมองโกล เจงกีสข่าน (1206-1227) การรุกรานตาตาร์-มองโกล ในปี 1241-1242 ชาวมองโกล-ตาตาร์ทำลายล้างโปแลนด์ สาธารณรัฐเช็ก และฮังการี การรณรงค์ครั้งแรกของ Batu ในภาคตะวันออกเฉียงเหนือของรัสเซีย...
-
การนำเสนอในหัวข้อ "ตัวละคร" การนำเสนอในหัวข้อ ตัวละครของมนุษย์
หากต้องการใช้ตัวอย่างการนำเสนอ ให้สร้างบัญชี Google และเข้าสู่ระบบ: https://accounts.google.com คำอธิบายภาพสไลด์: ตัวละครและอารมณ์ ดำเนินการโดยครูความปลอดภัยในชีวิตของ MCOU "โรงเรียนมัธยม Naryshkinskaya"...
-
การค้นพบที่ด้านล่างของร่องลึกบาดาลมาเรียนา
มีรอยเลื่อนลึกในเปลือกโลก - ทะเลกดลึกที่ด้านล่างของมหาสมุทร ที่ซึ่งความมืดมิดที่ไม่อาจทะลุทะลวงได้และความกดดันสูงสุดครอบงำ เราเสนอทางเลือกของท้องทะเลที่ลึกที่สุดซึ่งขาด...
-
นโปเลียน โบนาปาร์ต--สงคราม
การสู้รบมีสาเหตุหลักมาจากการที่รัสเซียปฏิเสธที่จะสนับสนุนการปิดล้อมภาคพื้นทวีปอย่างแข็งขัน ซึ่งนโปเลียนมองว่าเป็นอาวุธหลักในการต่อสู้กับบริเตนใหญ่ นอกจากนี้ Bonaparte ยังดำเนินนโยบายใน...
-
สูตรพื้นฐานทางฟิสิกส์ - ไฟฟ้าและแม่เหล็ก
การโต้ตอบ ปฏิกิริยาทางแม่เหล็กระหว่างเหล็กกับแม่เหล็กหรือระหว่างแม่เหล็กเกิดขึ้นไม่เพียงแต่เมื่อสัมผัสกันโดยตรงเท่านั้น แต่ยังเกิดขึ้นในระยะไกลด้วย เมื่อระยะทางเพิ่มขึ้น แรงโต้ตอบจะลดลง และ...







