Глицин (аминоуксусная кислота, гликокол, Gly, G). Химические свойства Натриевая соль аминокислоты
I. По числу функциональных групп
Моноаминомонокарбоновые кислоты
простейший представитель:

Моноаминодикарбоновые кислоты

Например:

Диаминомонокарбоновые кислоты

Например:

II. По взаимному положению карбоксильной и аминогруппы
-α-аминокислоты

- β-аминокислоты

- γ-аминокислоты

Формулы и названия некоторых α-аминокислот, остатки которых входят в состав белков

Белки представляют собой природные полимеры, макромолекулы которых построены из большого числа остатков 20 различных α-аминокислот. В биохимии для аминокислот используют, как правило, короткие тривиальные названия и трехбуквенные обозначения.
Моноаминомонокарбоновые кислоты
|
Аминоэтановая, или аминоуксусная кислота, или глицин (гликокол) |
|
|
2-аминопропановая, или α-аминопропионовая кислота, или аланин |
|
|
2-амино-З-гидроксипропановая, или α-амино-β-гидроксипропионовая кислота, или серин |
|
|
2-амино-З-меркаптопропановая кислота, или β-меркаптоаланин, или цистеин |
|
|
2-амино-З-фенилпропановая кислота, или β-фенилаланин, или фенилаланин |
|
|
2-амино-3-(4-гидроксифенил)-пропановая кислота, или β-(n-гидроксифенип)-апанин, или тирозин |
|
|
2-амино-З-метилбутановая, или α-аминоизовалериановая кислота, или валин |
Моноаминодикарбоновые кислоты
Диаминомонокарбоновая кислота
Классификация природных аминокислот
I. Заменимые аминокислоты - могут синтезироваться в организме человека. К ним среди вышеперечисленных относятся: глицин, аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты.
II. Незаменимые аминокислоты - не могут синтезироваться в организме человека, должны поступать в организм в составе белков пищи. Фенилаланин, валин, лизин - представители незаменимых аминокислот.
Физические свойства
Большинство аминокислот - бесцветные кристаллические вещества, хорошо растворимые в воде. Многие аминокислоты имеют сладкий вкус. Температуры плавления разных аминокислот лежат в пределах 230-300°C.
Химические свойства
Аминокислоты являются амфотерными соединениями, что обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH 2) характера.
1. Взаимодействие с основаниями

2. Взаимодействие с кислотами

3. Образование внутренних солей (биполярных ионов)
В водных растворах аминокислоты существуют в виде равновесных смесей молекул и биполярных ионов, которые в кислой среде переходят в катионную форму, а в щелочной среде - в анионную форму.
а) Моноаминомонокарбоновые кислоты

При образовании внутренних солей моноаминомонокарбоновых кислот характер среды не изменяется. Поэтому эти аминокислоты называются нейтральными. Суммарный заряд внутренних солей таких кислот равен нулю.
При добавлении кислоты (Н +) карбоксилат-ион протонируется и остается только положительный заряд на группе -NH
б) Моноаминодикарбоновые кислоты

При образовании внутренних солей моноаминодикарбоновых кислот образуется избыток ионов водорода, поэтому водные растворы этих кислот имеют рН
в) Диаминомонокарбоновые кислоты

При образовании внутренних солей диаминомонокарбоновых кислот образуется избыток гидроксид-ионов, поэтому их водные растворы имеют рН > 7. Такие аминокислоты называются основными. Суммарный заряд внутренних солей основных аминокислот положительный.
4. Образование пептидов
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются дипептиды:

При взаимодействии двух разных аминокислот образуется смесь четырех дипептидов; например:

Дипептид, присоединяя еще одну молекулу аминокислоты, может образовать трипептид. Аналогично из трипептида можно получить тетрапептид и т. д.
5. Образование производных по карбоксильной группе
Как и карбоновые кислоты, аминокислоты могут образовывать сложные эфиры, хлорангидриды и др. Например:

6. Поликонденсация ε-аминокапроновой кислоты

Способы получения
1. Аммонолиз α-галогенкарбоновых кислот
2. Гидролиз белков
Аминокислоты – это производные органических кислот, содержащие в радикале одну или несколько аминогрупп (NH 2).
По рациональной номенклатуре их названия имеют приставку «амино» и буквы греческого алфавита (α-, β-, γ- и т.д), указывающие положение аминогруппы по отношению к карбоксильной группе.
4-аминобутановая
(γ-аминомасляная)
В состав белков входят α-аминокислоты, которым дают тривиальные названия.
Аминокислоты подразделяются на моноаминокарбоновые, диаминокарбоновые, аминодикарбоновые, ароматические и гетероциклические: СН 3 –CHNH 2 –СООН аланин (α-аминопропионовая кислота);H 2 N–(СН 2) 4 –CHNH 2 –СООН лизин (α,ε-диаминокапроновая кислота); СООН–СН 2 –CHNH 2 –СООН аспарагиновая кислота (α-аминоянтарная кислота); С 6 Н 5 –СН 2 –CHNH 2 –СООН фенилаланин (α-амино-β-фенилпропионовая кислота);

(пирролидин-α-карбоновая кислота).
Все α-аминокислотны, часто встречающиеся в живых организмах, имеют тривиальные названия, которые обычно и употребляются в литературе.
Свойства аминокислот. Аминокислоты представляют собой кристаллические вещества, как правило, сладковатого вкуса, легко растворимые в воде.
В зависимости от количества амино- или карбоксильных функциональных групп в аминокислоте она может обладать основными (лизин) или кислотными свойствами (аспарагиновая кислота).
Аминогруппа и карбоксильная группа способны образовывать биполярный ион или внутреннюю соль:
NH 2 –СН 2 –СООН →NH 3 + –СН 2 –СОO – .
Наличие –NН 2 и –СООН групп в составе аминокислот обусловливают их амфотерные свойства (взаимодействуют как с основаниями, так и с кислотами).
H 2 N–СН 2 –СООН +NaOH→H 2 N–СН 2 –COONa+ Н 2 О
натриевая соль глицина
H 2 N–CH 2 –СООН +HCl→Cl –
хлористоводородная соль глицина
Со спиртами аминокислоты образуют сложные эфиры.
H 2 N–СН 2 –СООН
+ НОСН 3  NH 2 –СН 2 –СООСН 3 + Н 2 О
NH 2 –СН 2 –СООСН 3 + Н 2 О
метиловый эфир глицина
Характерно образование внутрикомплексных солей меди; реакция может использоваться при выделении аминокислот.

медная соль глицина
При нагревании α-аминокислоты превращаются в 1,4-дикетопиперазины.

β -Аминокислоты
при нагревании легко теряют аммиак,
образуя непредельные кислоты.
-Аминокислоты
при нагревании легко теряют аммиак,
образуя непредельные кислоты.
акриловая кислота
γ, δ, ε-Аминокислоты при нагревании превращаются в циклические амиды – лактамы.

ε-аминокапроновая кислота капролактам
Основная масса этого продукта используется для получения полиамидного волокна – капрона.
Аминокислоты, содержащие аминогруппу в α-положении, подвергаются реакции дегидратации с образованием полипептидов.
глицин аланин цистеин
Название полипептида составляется из названий радикалов кислот и полного названия кислоты, в которой сохраняется карбоксильная группа.
Способы получения. Получать аминокислоты можно при гидролизе белков или из галогенопроизводных кислот при действии аммиака:
α-бромпропионовая кислота аланин
α-Аминокислоты входят в состав белковой составляющей пищи и делятся на заменимые и незаменимые.
Заменимые аминокислоты могут синтезироваться организмом человека или животного. Незаменимые аминокислоты (метионин, валин, лейцин, фенилаланин, изолейцин, триптофан, лизин, треонин) не образуются в живом организме и для его нормальной жизнедеятельности должны поступать с пищей. Например, недостаток лизина сказывается на кроветворной функции и кальцификации костей; метионин обладает противосклеротическим действием; триптофан важен для процесса роста, обмена веществ.
Природным источником получения α-аминокислот являются белковые вещества (при гидролизе).
Аминокислоты входят в состав растений, микроорганизмов, животных и человека и играют громадную роль в процессах жизнедеятельности организмов.
Белки – это природные высокомолекулярные азотсодержащие органические соединения, молекулы которых построены из α-аминокислот, связанных пептидными связями, то есть белки являются полипептидами.
остаток остаток остаток
аланина серина цистеина
Белки широко распространены в природе, особенно много их в организмах животных и человека. Большое количество белков содержится в костях, хрящах, мышцах, в нервных тканях. Из белков состоят волосы, шерсть, перья, чешуя рыб, копыта, рога и т.п. Белки содержатся в яйцах птиц, входят в состав молока, крови и др. Ферменты, гормоны, вирусы также имеют белковую природу.
Строение белков. Все белки содержат углерод, водород, кислород, азот (режеS,P,Fe).
Молекулярный вес белков чрезвычайно велик – от 5000 до многих миллионов.
Последовательность, с которой соединяются остатки α-аминокислот в цепи, называется первичной структурой белка. Она строго уникальна для каждого вида белка.
Полипептидная цепь обычно имеет форму
спирали. Склонность полипептидной
цепи к скручиванию в спираль
предопределяется первичной структурой
белка, но её прочность определяется
образованием водородных связей между
группами
 и
–NH– соседних витков
спирали.
и
–NH– соседних витков
спирали.
Например:

Особенность скручивания полипептидных цепей белковых молекул в спираль называется вторичной структурой белков.
Витки спирали могут так или иначе складываться или сгибаться вследствие наличия дисульфидных мостиков –S–S–, удерживающих в непосредственной близости те или иные витки, эту роль могут выполнять и водородные связи. В результате такого складывания участков спирали создаётся подобие клубка. Эта форма строения белков называетсятретичной структурой.
В молекулах некоторых белков образуется по несколько таких «клубков» (глобул), вследствие чего возникает четвертичная структура. Связи, соединяющие субъединицы белка в молекулу с четвертичной структурой, – это не ковалентные, а более слабые связи, например водородные (как в молекуле гемоглобина), ионные или так называемые гидрофобные взаимодействия. Белки, имеющие четвертичную структуру, вследствие непрочности связей, соединяющих субъединицы, обладают способностью обратимо диссоциировать на субъединицы. При этом может исчезать ферментативная активность белков.
Классификация белков. Белки делятся на две основные группы: протеины (простые белки) и протеиды (сложные белки). Протеины состоят только из аминокислот и при гидролизе не образуют других продуктов. Протеиды состоят из белковой части, построенной из α-аминокислот, и из небелковой части (простетической группы). При гидролизе эти белки, кроме α-аминокислот, поставляют и другие вещества: углеводы, фосфорную кислоту, гетероциклические соединения, красящие вещества и т.п.
К протеинам относится ряд простых белков, имеющих различную растворимость в разных растворителях.
Альбумины – белки, растворимые в воде, не осаждаются насыщенным раствором хлорида натрия, но осаждаются насыщенным раствором сульфата аммония, свёртываются при нагревании. Представители: альбумины яйца, молока, сыворотки крови, белки ферментов и семян растений.
Глобулины – белки, нерастворимые в воде, но растворимые в разбавленных солевых растворах; свёртываются при нагревании. Имеют большую молекулярную массу, чем альбумины. Представители: глобулины молока, яйца, крови, белка мышц (миозин), семян растений.
Проламины – белки, растворимые в 70–80%-ном спирте, нерастворимые в воде и безводном спирте. Не свёртываются при кипячении. Представители: белки злаков (глиадин – в пшенице, зеин – в кукурузе).
Глютелины – растительные белки, нерастворимые в нейтральных солевых растворах и в этиловом спирте; растворяются только в разбавленных (0,2%) растворах щелочей. Содержатся, главным образом, в семенах злаков. Глютелины некоторых злаков называют глютенинами (от слова клейковина).
Гистоны – белки основного характера, так как содержат значительное количество диаминокислот, растворимые в воде и в разбавленных кислотах, но нерастворимые в разбавленных щелочах. Обычно представляют белковые части сложных белков. Представители: глобин – белок, входящий в состав гемоглобина.
Протамины – наиболее простые из природных белков с низкими молекулярными массами; состоят преимущественно из диаминокислот и являются сильными основаниями. Хорошо растворимы в воде, в разбавленных кислотах и щелочах. Не свёртываются при нагревании. Представители протаминов обнаружены в сперматозоидах рыб, в составе сложных белков – нуклеопротеидов.
Альбуминоиды (склеропротеины) – белки, резко отличающиеся от других белков по свойствам. Они растворяются лишь при длительной обработке концентрированными кислотами и щелочами с расщеплением молекул. В животных организмах выполняют опорные и покровные функции, в растениях не встречаются. Представителями склеропротеинов являются: фиброин – белок шёлка; кератин – белок волос, шерсти, рогового вещества, эпидермиса кожи; эластин – белок стенок кровеносных сосудов, сухожилий; коллаген – белковое вещество кожи, костей, хрящей, соединительных тканей.
Протеиды – сложные белки, подразделяющиеся на подгруппы в зависимости от характера простетической (небелковой) части.
Фосфопротеиды – белки, содержащие в качестве простетической группы остаток фосфорной кислоты. Представители: казеин – белок молока, вителлин – белок, входящий в состав желтка куриного яйца.
Нуклеопротеиды – белки, в которых собственно белковая часть связана с нуклеиновыми кислотами, а последние при гидролизе образуют фосфорную кислоту, гетероциклические соединения и углевод. Нуклеопротеиды входят в состав ядер растительных и животных клеток.
Хромопротеиды – вещества, в которых белковая часть соединена с красящим веществом. Представитель: гемоглобин крови, при гидролизе он расщепляется, образуя белок глобин и красящее вещество – гем.
Глюкопротеиды – белки, у которых белковая часть соединена с углеводом. Представитель: муцин, входящий в состав слюны.
Липопротеиды – соединения белков с липидами; к последним относятся жиры, фосфатиды и др. Липопротеиды содержатся в протоплазме клеток, в сыворотке крови, в яичном желтке.
Белковые вещества классифицируют также по форме их молекул, подразделяя на две группы:
а) фибриллярные (волокнистые) белки, молекулы которых имеют нитевидную форму; к ним относятся фиброин шёлка, кератин шерсти, миозин мышц;
б) глобулярные белки, молекулы которых имеют округлую форму; к ним относятся альбумины, глобулины и ряд сложных белков.
Пищевая ценность белков обусловлена качественным и количественным составом входящих в них аминокислот. Различают полноценные и неполноценные белки.
Полноценные белки содержат все незаменимые аминокислоты (казеин молока, яичный альбумин, белок мяса).
Неполноценными называют белки, которые не содержат хотя бы одну из незаменимых аминокислот (зеин кукурузы, желатин).
Свойства белков. Белковые вещества разнообразны по своему агрегатному состоянию. Часто это твёрдые аморфные вещества, имеющие вид белых порошков. Белки шерсти (кератин) и шёлка (фиброин) – прочные волокна. Некоторые белки получены в кристаллическом состоянии (гемоглобин крови), многие имеют консистенцию вязких жидкостей или студней.
Все белки не растворяются в безводном спирте и других органических растворителях. Многие белки растворяются в воде и в разбавленных растворах солей, но образуют не истинные, а коллоидные растворы. Существуют белки, совершенно нерастворимые в воде.
Растворы природных белков оптически активны (в основном обладают левым вращением).
Белки, подобно аминокислотам, амфотерны и образуют соли как с кислотами, так и с основаниями:
H 3 N + –R–COO –
+ H + +
Cl –  NH 3 + –R–COOH
+ Сl – ;
NH 3 + –R–COOH
+ Сl – ;
H 3 N + –R–COO –
+ Na +
+ OH –  NH 2 –R–COO –
+ Na +
+ H 2 O.
NH 2 –R–COO –
+ Na +
+ H 2 O.
В присутствии кислот белковые молекулы несут положительный заряд и при электролизе передвигаются к катоду, в присутствии щелочей белковые молекулы несут отрицательный заряд и передвигаются к аноду. При определённом значении рН в растворе будет содержаться минимальное количество катионов и анионов белка; в этих условиях передвижение молекул белка при электрофорезе не происходит. Значение рН раствора, при котором в растворе белка содержится минимальное количество катионов и анионов, называется изоэлектрической точкой. Для различных белков значение изоэлектрической точки неодинаково. Например, для яичного белка (альбумина) изоэлектрическая точка находится при рН=4,8, для белка пшеницы (глиадина) – при рН=9,8.
Для всех белков характерны некоторые общие свойства: реакции осаждения из растворов и цветные реакции.
Осаждение белков из растворов. При добавлении к водным растворам белков концентрированных растворов минеральных солей (например, (NH 4) 2 SO 4) белки осаждаются, аналогично действует на белок спирт, ацетон. Во всех этих случаях белки не изменяют своих свойств и при разбавлении водой вновь переходят в раствор. Этот процесс называетсявысаливанием.
При нагревании многие белки свёртываются (например, яичный белок) и тоже осаждаются из растворов, но теряют способность растворяться в воде. При этом происходит значительное изменение свойств белков. Этот процесс необратимого осаждения белков называется денатурацией. Денатурацию могут вызывать соли тяжёлых металлов (CuSO 4 ,Pb(CH 3 COO) 2 ,HgClи др.), концентрированные кислоты (HNO 3 ,H 2 SO 4 ,CH 3 COOH, пикриновая, хлоруксусная), едкие щёлочи (КОН,NaOH), фенол, формалин, таннин и др.
Денатурацию белка вызывают также различные виды излучений (ультрафиолетовое, радиоактивное и т.п.). При денатурации разрушается четвертичная, третичная, вторичная структуры; первичная структура при этом обычно сохраняется, то есть разрушение пептидных связей не происходит. Первичная структура белка разрушается при гидролизе белка, что и происходит в процессе усвоения белковой пищи. В желудочно-кишечном тракте под действием ферментов белки пищи расщепляются через ряд промежуточных продуктов до аминокислот. Из комбинации полученных аминокислот в организме создаются необходимые ему белки. Неиспользованные остатки белков подвергаются разрушению до более простых соединений и выводятся из организма.
Цветные реакции белков.
1. Биуретовая реакция.
При взаимодействии с солями меди (CuSO 4) в щелочной среде все белки дают фиолетовое окрашивание. Эта реакция является качественной на пептидные связи и подтверждает наличие их в белках и полипептидах. Для различных полипептидов окраска, возникающая при взаимодействии с солями меди, неодинакова: дипептиды дают синюю окраску, трипептиды–фиолетовую, а более сложные полипептиды–красную.
2. Ксантопротеиновая реакция.
При нагревании растворов белков с концентрированной азотной кислотой (HNO 3) они окрашиваются в жёлтый цвет. Реакция объясняется наличием в белках аминокислот, содержащих ароматические углеводородные радикалы (С 6 Н 5 –), которые при взаимодействии с азотной кислотой образуют нитросоединения, окрашенные в жёлтый цвет.
3. Цистиновая реакция (сульфгидрилъная).
Если прокипятить раствор белка с избытком едкого натра и прибавить несколько капель раствора ацетата свинца Рb(СН 3 СОО) 2 , то появляется буро-чёрное окрашивание или осадок.
Белок + NaOH Na 2 S+ др. вещества.
Na 2 S+ др. вещества.
Na 2 S + Pb(CH 3 COO) 2 → PbS↓ + 2CH 3 COONa.
Реакция подтверждает наличие слабо связанной серы в белках.
Имеется и ряд других качественных реакций на белок.
Значение и применение белков. Белки являются важнейшей составной частью пищевых продуктов. Более 50% белков в рационе питания человека должны составлять белки животного происхождения. Взрослому человеку в сутки требуется 80–100 г белка, а при большой физической нагрузке – 120 г и более.
Белковые вещества находят широкое применение в производстве промышленных товаров (изделия из кожи, шерсти, меха, шёлка), в производстве клея, желатина, пластмасс (галалита), искусственной шерсти, для приготовления светочувствительных эмульсий в фотопромышленности и др.
Многие лекарственные препараты имеют белковую природу (инсулин, панкреотин и др.). Особо следует выделить биологические катализаторы – ферменты, также являющиеся белковыми веществами. Часто присутствуя лишь в ничтожных количествах, они способствуют быстрым химическим превращениям огромных количеств различных веществ в очень мягких условиях (низкая температура и т.д.).
Вирусы, бактерии также имеют белковую природу. Поэтому при консервировании пищевых продуктов, лечении различных заболеваний используют препараты, которые денатурируют белковые вещества (салициловая кислота, аспирин, салол, таннин, различные полифенолы, уксусная кислота и др.).
Белки являются веществами, совершенно необходимыми для жизни животных, растений, микроорганизмов. Сама жизнь является процессом сложных превращений белковых веществ.
Глицин (аминоуксусная кислота, гликокол, Gly, G)
H 2 NCH 2 COOH
Молекулярная масса 75,07; бесцветные кристаллы; t плавления 232-236°С (с разложением); хорошо растворим в воде, не растворим в большинстве органических растворитеей. При 25°С рК а 2,34 (СООН) и 9,6 (NH 2); рI 5,97.
По химическим свойствам глицин - типичная алифатическая α-аминокислота. Количественное определение основано на образовании окрашенных продуктов с о-фталевым альдегидом (реакция Циммермана). В составе белков встречается чаще, чем др. аминокислоты. Служит предшественником в биосинтезе порфириновых соединений и пуриновых оснований. Глицин - кодируемая аминокислота, заменимая; его биосинтез осуществляется переаминированием глиоксиловой кислоты, ферментативным расщеплением серина и треонина. Синтезируют лицин из хлоруксусной кислоты и NH 3 . В спектре ЯМР в D 2 О химический сдвиг протонов группы СН 2 составляет 3,55 м.д. Внутренняя соль глицина (CH 3) 3 + NCH 2 COO - называется бетаином.
Применяется глицин для синтеза пептидов, как компонент буферных растворовров, в смеси с другими аминокислотами - для парентерального питания.
Хроматограммы образцов, содержащих это вещество
Аминокислоты — это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:
Н 2 N -СН 2 -СООН + HCl → Сl [Н 3 N-СН 2 -СООН],
Н 2 N -СН 2 -СООН + NaOH → H 2 N-CH 2 -COONa + Н 2 О.
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
H 2 N-CH 2 -СООН + Н 3 N -СН 2 -СОO — .
Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей общей схемой:

Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH 2), лизин — щелочной (одна группа -СООН, две -NH 2).
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота - в гидроксикислоту:
H 2 N-CH(R)-COOH + HNO 2 → HO-CH(R)-COOH + N 2 + H 2 O
Измерение объема выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка ).
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир (точнее, в хлороводородную соль эфира):
H 2 N-CH(R)-COOH + R’OH H 2 N-CH(R)-COOR’ + Н 2 О.
Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
Важнейшее свойство аминокислот - их способность к конденсации с образованием пептидов.
Качественные реакции .
1) Все аминокислоты окисляются нингидрином

с образованием продуктов, окрашенных в сине-фиолетовый цвет. Иминокислота пролин дает с нингидрином желтое окрашивание. Эта реакция может быть использована для количественного определения аминокислот спектрофотометрическим методом.
2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называется ксантопротеиновой (от греч. ксантос - желтый).
Белки – это полипептиды достаточно
большой молекулярной массы, имеющие
определенную пространственную структуру,
которая зависит от последовательности входящих
в белковую цепь аминокислот. Эта структура может
быть компактной (глобулярные белки) или
вытянутой (фибриллярные белки). Все ферменты –
глобулярные белки, к фибриллярным же относятся
коллаген, кератин – белки кожи, волос, очень
прочные и хорошо растяжимые.
По составу белки делят на простые, состоящие
только из аминокислот, и сложные – комплексы или
ковалентные соединения полипептидов с
молекулами других классов:
нуклеиновыми кислотами –
нуклеопротеиды;
полисахаридами – гликопротеины;
липидами – липопротеиды;
пигментами – хромопротеиды;
остатками фосфорной кислоты – фосфопротеиды.
Белковую часть сложного белка называют апобелком , небелковую – простетической группой . Почти все простые и сложные глобулярные белки являются ферментами – биологическими катализаторами биохимических реакций в живых организмах.
Задачи
Задача 1. Какой объем газа (в нормальных условиях) выделится при реакции с азотистой кислотой 0,001 моля аминокислоты: а) лейцина; б) лизина; в) пролина?
Решение
Запишем уравнения реакций перечисленных аминокислот с азотистой кислотой. В случае лейцина и лизина происходит дезаминирование по Ван-Слайку, причем у лизина – по двум аминогруппам, содержащимся в молекуле. В пролине нет первичной аминогруппы, поэтому процесс останавливается на стадии N-нитрозирования.
В реакции (а) количество молей лейцина n(Лей) равно количеству молей выделевшегося азота n(N 2), поэтому выделяется 0,001 моля, или 22,4 мл азота. В реакции (б) образуется удвоенное количество газа 2n(N 2) по сравнению с n(лиз), так как в исходной аминокислоте две первичные аминогруппы; объем выделившегося азота составит 44,8 мл. В реакции (в) азот не выделяется: пролин – единственная из 20 важнейших аминокислот, у которой в a-положении находится вторичный атом азота. При его нитрозировании образуется N-нитрозо- (а не диазо-) соединение.
Ответ: а) 22,4 мл N 2 ; б) 44,8 мл N 2 ; в) нет выделения N 2 .
Задача 2. В результате обработки раствора, содержащего 9,36 мг неизвестной аминокислоты, избытком азотистой кислоты при 748 мм рт.ст. и 20 °С получено 2,01 мл азота. Какова минимальная молярная масса этой аминокислоты?
Решение
Реакция аминокислоты с азотистой кислотой:

Используя объединенный газовый закон PV/T = const , рассчитаем объем азота при нормальных условиях (при температуре 0 °С, или 273 °К, и давлении 760 мм рт.ст.): V 0 (N 2) (н.у.) = (Р 1 ·V 1 ·T 0)/(P 0 ·T 1) = (748·2,01·273)/(760·293) = 1,84 мл.
Поскольку количества молей вещества
аминокислоты и выделяющегося газа N2 одинаковы,
составим пропорцию:
9,36 мг аминокислоты дает 1,84 мл N 2 ;
M (молекулярная масса аминокислоты) даст = 22,4 N 2 .
М = (9,36·22,4)/1,84 = 114.
Это может быть валин:
Задача 3. Гемоглобин животного содержит 0,335% железа (по массе). Какова минимальная молярная масса этого белка? Сколько атомов железа входит в состав молекулы, если определенная методом измерения осмотического давления молекулярная масса белка равна 67000?
Решение
Массовая доля железа в гемоглобине: С%(Fe) = /M(белка), где n – число атомов Fe в молекуле белка. Пусть n = 1, тогда М(белка)1 = M(Fe)·100%/C%(Fe) = 56·100/0,335 = 16700. Поскольку истинное значение (по условию) М(белка) ист. = 67000, n = М ист./М 1 = 67000/16700 = 4.
Задача 4. При щелочном гидролизе 48 г дипептида, состоящего из остатков одной и той же аминокислоты, образовалось только одно вещество – натриевая соль аминокислоты. Масса этой соли равна 66,6 г. Установите строение дипептида.
Решение
Уравнение реакции щелочного гидролиза дипептида:
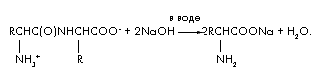
Обозначим количество дипептида в молях (дипептида) = х. Тогда в реакции гидролиза расходуется удвоенное количество щелочи (NaOH) = 2х и образуется (аминокислоты) = 2х и (H2O) = х. Составим уравнение материального баланса, используя формулу m = ·M;
m(дипептида) + m(NaOH) = m(соли аминокислоты)
+ m(H 2 O); 48 + 2х·40 = 66,6 + х·18; 62х = 18,6;
х = 0,3 моля. M(дипептида) = m/ = 48/0,3 = 160. M(аминокислоты) =
[М(дипептида) + M(H 2 O)]/2 = 178/2 = 89 г/моль.
Аминокислота – аланин. Строение дипептида:![]() .
.
Похожие статьи
-
Экватор - что же это такое
Экватор в переводе с латыни означает "уравнивать" . Принято считать, что экватор - это условная окружность, делящая земной шар на северное и южное полушария, и самая длинная окружность (или параллель) Земли, перпендикулярная ее оси...
-
Загадочные корабли-призраки, о которых ходят легенды
Их называют корабли-призраки или же фантомы. Они являются одной из множества тайн, которую океаны прячут от человека. Морякам во все времена своими рассказами о них ничего не стоило напугать до смерти человека, который был расположен...
-
Продленка в начальной школе: нормативно-правовая база, программа Почему в школе нет продленки
С молниеносной скоростью летит время. Еще вчера мы думали, какую коляску купить ребенку, а сегодня он будущий первоклассник. До школы остается совсем немного времени, и родители начинают задумываться о том, как же правильно организовать...
-
doc - «Влияние семейного воспитания на формирование личности ребёнка
МБОУ СОШ 16 Цель собрания : Формирование у родителей положительного отношения к совместной работе по оформлению портфолио; информирование по организации ведения портфолио. Задачи : Дать необходимые сведения по «Положению о портфолио...
-
Томский государственный университет систем управления и радиоэлектроники (тусур)
Школьные годы, конечно, чудесные, но дальше годы - еще лучше. Это я о прекрасной поре студенчества. Чтобы помочь абитуриентам сделать первые шаги в это замечательное время, а именно определиться с университетом, наша газета запускает серию...
-
Есенина: факультеты, отзывы
Рязанский государственный педагогический университет Рязанский государственный университет имени С. А. Есенина (РГУ ) Год основания Ректор Ирина Михайловна Шеина Расположение Рязань Сайт www.rsu.edu.ru Ряза́нский...







