Что влияет на экспрессивность гена. Лекция: Влияние факторов среды на действие генов (плейотропия, экспрессивность, пенетрантность). Типы наследования признаков, их характеристика. Экспрессивность и пенетрантность
Ген, имеющийся в генотипе в необходимом для проявления количестве (1 аллель для доминантных признаков и 2 аллеля для рецессивных) может проявляться в виде признака в разной степени у разных организмов (экспрессивность) или вообще не проявляться (пенетрантность). Причины:
- модификационная изменчивость (воздействие условий окружающей среды)
- комбинативная изменчивость (воздействие других генов генотипа).
Экспрессивность - степень фенотипического проявления аллеля. Например, аллели групп крови АВ0 у человека имеют постоянную экспрессивность (всегда проявляются на 100%), а аллели, определяющие окраску глаз, - изменчивую экспрессивность. Рецессивная мутация, уменьшающая число фасеток глаза у дрозофилы, у разных особей по разному уменьшает число фасеток вплоть до полного их отсутствия.
Пенетрантность - вероятность фенотипического проявления признака при наличии соответствующего гена. Например, пенетрантность врожденного вывиха бедра у человека составляет 25%, т.е. болезнью страдает только 1/4 рецессивных гомозигот. Медико-генетическое значение пенетрантности: здоровый человек, у которого один из родителей страдает заболеванием с неполной пенетрантностью, может иметь непроявляющийся мутантный ген и передать его детям.
Проявление действия гена имеет определенные характеристики.
Один и тот же мутантный ген у разных организмов может проявить свой эффект различным образом. Это обусловлено генотипом данного организма и условиями внешней среды, при которых протекает его онтогенез.
Фенотипическое проявление гена может варьировать по степени выраженности признака. Это явление Н.
В. Тимофеев-Ресовский еще в 1927 г. предложил называть экспрессивностью гена. Действие гена может быть более или менее константным, стойким в своем проявлении или нестойким, вариабильным. С изменчивостью проявления мутантного гена у разных организмов мы действительно встречаемся довольно часто. У дрозофилы имеется «безглазая» мутантная форма (eyeless) с сильно редуцированным числом фасеток. Просматривая потомство одной родительской пары, можно видеть, что у одних мух глаза почти полностью лишены фасеток, тогда как у других число фасеток в глазах достигает половины нормального числа.
Такое же явление наблюдается в реализации многих признаков и у других животных и растений.
Один и тот же мутантный признак может проявляться у одних и не проявляться у других особей родственной группы. Это явление Н. В. Тимофеев-Ресовский назвал пенетрантностью проявления гена. Пенетрантность измеряется по проценту особей в популяции, имеющих мутантный фенотип.
При полной пенетрантности (100%) мутантный ген проявляет свое действие у каждой особи, обладающей им; при неполной пенетрантности (меньше 100%) ген проявляет свой фенотипический эффект не у всех особей.
Экспрессивность , как и пенетрантность, обусловлена взаимодействием генов в генотипе и различной реакцией последнего на факторы внешней среды. Экспрессивность и пенетрантность характеризуют фенотипическое проявление гена. Пенетрантность отражает гетерогенность линий, популяций не по основному гену, определяющему конкретный признак, а по генам - модификаторам, создающим генотипическую среду для проявления гена.
Экспрессивность есть реакция сходных генотипов на среду. Оба указанных явления могут иметь приспособительное значение для жизни организма и популяции, и поэтому экспрессивность и пенетрантность проявления гена поддерживаются естественным отбором. Эти два явления очень важно учитывать и при искусственном отборе.
Экспрессивность гена в развитии зависит от действия факторов внешней среды.
Легче всего пока удается проследить влияние различных внешних агентов на мутантные гены. Так, у кукурузы известны мутантные гены, определяющие карликовость растений, положительный геотропизм (наклоняющиеся растения) и др. В основе действия этих генов лежат соответствующие биохимические изменения. Известно, например, что для нормального роста растения необходимы ростовые вещества типа ауксинов. У мутантной карликовой формы кукурузы ауксин вырабатывается нормально, но ген карликовости тормозит образование фермента, который окисляет ауксин, вследствие чего понижена активность ауксина, что и приводит к торможению роста растений.
Если на такое растение воздействовать во время роста гиббереллиновой кислотой, то растение ускоряет рост и становится по фенотипу неотличимым от нормального.
Добавка гиббереллиновой кислоты как бы восполняет то, что должна была бы произвести нормальная аллель гена карликовости.
Влияние гиббереллиновой кислоты на рост кукурузы
Из этого примера видно, что ген контролирует образование определенного фермента, который изменяет характер роста растения. Таким образом, зная механизм действия мутантного гена, можно исправлять и нормализовывать вызываемые им дефекты.
Вспомним, что гималайская окраска кролика определяется одним членом серии множественных аллелей - с11.
Обычное фенотипическое проявление этого гена при нормальной температуре (около 20°) характеризуется тем, что при общей белой окраске шерсти кончики лап, уши, нос и хвост кролика оказываются черными.

Фенотипическое изменение окраски шерсти гималайского кролика под влиянием различных температур
Такая окраска зависит как от определенных биохимических реакций, протекающих в коже, связанных с выработкой меланистических пигментов, так и от температуры окружающей среды.
На том же рисунке показано, что кролик, выращенный при температуре выше 30°, оказывается сплошь белым. Если же выщипать небольшой участок белой шерсти и потом систематически его охлаждать, то на нем вырастает черная шерсть. В данном случае действие температуры сказывается на проявлении гена, влияя на выработку определенных ферментов.
У растения примулы известен ген окраски цветка, который также проявляет свое действие в зависимости от температуры.
Если растения выращиваются при температуре 30-35° и высокой влажности, то цветки будут белыми, а при более низкой температуре - красными.
Еще в 1935 г. Ф. А. Смирнов провел работу по изучению числа индуцированных мутаций у дрозофилы: летальных, семилетальных и мутаций с повышенной и нормальной жизнеспособностью, и обнаружил разное соотношение перечисленных классов в разных температурных условиях.
Позднее это же подтвердилось и на популяциях Drosophila pseudoobscura. Из дикой популяции этого вида были выделены мутанты, которые нормально развивались при температуре 16,5°, при 21° они были полулегальными, а при 25° оказывались полностью летальными. Такого рода исследования теперь ведутся на мутациях микроорганизмов.
Эти мутации называются amber-мутациями.
У наездника Habrobracon hebitor известен ген kidney (k). Он имеет почти 100%-ную пенетрантность как леталь при 30°, а при низкой температуре развития почти не проявляется. Такого типа зависимость пенетрантности от условий среды известна для большинства мутаций у всех животных, растений и микроорганизмов.
Действие одного и того же фактора внешней среды сказывается различным образом на разных генах, и разные факторы различным образом влияют на проявление одного и того же гена.
Изучение влияния факторов внешней среды показало, что некоторые рецессивные гены, которые в обычных условиях в гетерозиготном состоянии фенотипически не проявляются, могут проявиться при измененных условиях.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Вконтакте
Одноклассники
Никакие признаки не наследуются . Признаки развиваются на основе взаимодействия генотипа и среды. Наследуется только генотип, т.е. комплекс генов, который определяет норму биологической реакции организма, изменяющую проявление и выраженность признаков в разных условиях среды.
Таким образом, организм реагирует на свойства внешней среды. Иногда один и тот же ген в зависимости от генотипа и от условий внешней среды по-разному проявляет признак или меняет полноту выраженности.
Степень проявления фенотипа – экспрессивност ь. Образно ее можно сравнить со степенью тяжести болезни в клинической практике. Экспрессивность подчиняется законам распределения Гаусса (некоторые в малом или среднем количестве).
В основе изменчивости экспрессивности лежат и генетические факторы, и факторы внешней среды. Экспрессивность – очень важный показатель фенотипического проявления гена. Количественно ее степень определяют, используя статистический показатель.
Экспрессивность также является показателем, характеризующим фенотипическое проявление наследственной информации.
Она характеризует степень выраженности признака и, с одной стороны, зависит от дозы соответствующего аллеля гена при моногенном наследовании или от суммарной дозы доминантных аллелей генов при полигенном наследовании, а с другой - от факторов среды. Примером служит интенсивность красной окраски цветков ночной красавицы, убывающая в ряду генотипов АА, Аа, аа, или интенсивность пигментации кожи у человека, увеличивающаяся при возрастании числа доминантных аллелей в системе полигенов от 0 до 8 (см.
рис. 3.80). Влияние средовых факторов на экспрессивность признака демонстрируется усилением степени пигментации кожи у человека при ультрафиолетовом облучении, когда появляется загар, или увеличением густоты шерсти у некоторых животных в зависимости от изменения температурного режима в разные сезоны года.
Генетический признак может даже не проявляться в некоторых случаях.
Если ген есть в генотипе, но он вовсе не проявляется – он пенетрирован. (русский ученый Тимофеев-Рисовский 1927 год). Пенетрантность – количество особей (%), проявляющих в фенотипе данный ген, по отношению к количеству особей, у которых этот признак мог бы проявиться.
Пенетрантность свойственна проявлению многих генов. Важен принцип – «все или ничего» — либо проявляется, любо нет.
— наследственный панкреатит – 80%
— вывих бедра – 25%
— пороки развития глаз
— ретинобластома – 80%
— отосклероз – 40%
— колотокома – 10%
— Пенетрантностъ отражает частоту фенотипического проявления имеющейся в генотипе информации.
Она соответствует проценту особей, у которых доминантный аллель гена проявился в признак, по отношению ко всем носителям этого аллеля.
Неполная пенетрантность доминантного аллеля гена может быть обусловлена системой генотипа, в которой функционирует данный аллель и которая является своеобразной средой для него. Взаимодействие неаллельных генов в процессе формирования признака может привести при определенном сочетании их аллелей к непроявлению доминантного аллеля одного из них.
Хорея Гентингтона проявляется в непроизвольном подергивании головы. Конечностей, постепенно прогрессирует и приводит к смерти.
Может проявиться в раннем постэмбриональном периоде, в зрелом возрасте или не проявиться вообще. И экспрессивность, и пенетрантность поддерживаются естественным отбором, т.е.
гены, контролирующие патологические признаки могут иметь разную экспрессивность и пенетрантность: заболевают не все носители гена, а у заболевших степень проявления будет различна.
Проявление или неполное проявление признака, а так же его отсутствие зависит от среды и от модифицирующего действия других генов.
Ген может действовать плейотропно (множественно), т.е. опосредовано влиять на течение разных реакций и развитие многих признаков. Гены могут оказывать влияние на другие признаки на разных стадиях онтогенеза.
Если ген включается в позднем онтогенезе, то оказывается незначительное действие. Если на ранних стадиях – изменения более значительны.
Фенилкетанурия. У больных есть мутация, которая выключает фермент – фенилаланин – гидролазу. Поэтому фенилаланин не превращается в тирозин. В результате в крови количество фенилаланина повышается. Если выявить эту патологию рано (до 1 месяца) и перевести ребенка на другое питание, развитие идет нормально, если позднее – понижен размер головного мозга, умственная отсталость, не развиваются нормально, отсутствует пигментация, умственные способности минимальны.
Плейотропность отражает интеграцию генов и признаков.
У человека есть патологический ген, приводящий к синдрому Фанкони (порок развития или отсутствие большого пальца, порок или отсутствие лучевой кости, недоразвитие почки, коричневые пигментные пятна, нехватка кровяных телец).
Есть ген, связанный с Х-хромосомой.
Невосприимчивость к инфекциям и нехватка кровяных телец.
Доминантный ген, сцепленный с Х-хромосомой – пилонефрит, лабиринтная тугоухость.
Синдром Марфани – паучьи пальцы, вывих хрусталика глаза, пороки развития сердца.
Генокопия (греч.
Понятие о пенетрантности и экспрессивности генов.
genos род, происхождение + лат. copia множество) — термин в 1957 г. предложил
немецкий генетик Нахтсхейм (H.Nachtsheim).Обозначает сходные изменения одного и того же признака под влиянием разных неаллельных генов, которые иногда называют миметическими генами гетерогенной группы.
genocopies — генокопии.
Oдинаковые изменения фенотипа, обусловленные аллелями разных генов, а также имеющие место в результате различных генных взаимодействий или нарушений различных этапов одного биохимического процесса с прекращением синтеза конечного продукта, — например, у Drosophila melanogaster известен ряд мутаций неаллельных генов, обусловливающих фенотип “красные глаза” (нарушен синтез коричневого пигмента).
42.Изменчивость.
Формы изменчивости: модификационная и генотипическая, их значение в онтогенезе и эволюции.
Изменчивость
Одним из признаков жизни является изменчивость.
Любой живой организм отличается от других представителей вида
Изменчивость – свойство живых организмов существовать в разных формах. Групповая и индивидуальная изменчивость – классификация по эволюционному значению.
Изменчивость, реализованная группой организмов, называется групповой, у одного организма или группы его клеток – индивидуальная.
—фенотипическая
— случайная
— модификационная
—генотипическая
— соматическая
— генеративная (мутационная, комбинативная)
а) генная
б) хромосомная
в) геномная
Модификационная изменчивость
фенокопии . Фенокопии – вызванные условиями внешней среды фенотипические модификации, имитирующие генетические признаки.
Изменчивость бывает наследственная (неопределенная, индивидуальная генотипическая) и ненаследственная (определенная, групповая, модификационная). Наследственная изменчивость связана с изменением генотипа, ненаследственная- с изменением фенотипа под влиянием условий окружающей среды.
Значение мод.изм.: Адаптация- приспособление к данным условиям среды
Значение генотип.
изм:Материал для естественного и искусственного отбора, распространение в популяции новых наследственных изменений.
43.Фенотипическая изменчивость и её виды. Модификации и их характеристики.
Норма реакции признака. Фенокопии. Адаптивный характер модификаций.
По характеру изменения признаков и механизму:
—фенотипическая
— случайная
— модификационная
Модификационная изменчивость отражает изменение фенотипа под воздействием факторов внешней среды (усиление и развитие мышечной и костной массы у спортсменов, увеличение эритропоэза в условиях высокогорья и крайнего севера).
Частный случай фенотипической изменчивости – фенокопии . Фенокопии – вызванные условиями внешней среды фенотипические модификации, имитирующие генетические признаки. Под влиянием внешних условий на генетически нормальный организм копируются признаки совсем другого генотипа.
Проявление дальтонизма может произойти под влиянием питания, плохой психической конституции, повышенной раздражительности.
У человека возникает заболевание витилиго (1% людей) – нарушение пигментации кожи. Генетический дефект есть у 30% болеющих, у остальных – профессиональное витилиго (воздействие на организм особых химических и отравляющих веществ). В Германии 15 лет назад рождались дети с фекомелией – укороченными ластовидными руками. Выяснилось. Что рождение таких детей происходило, если мать принимала Телидомид (успокоительное средство, показанное беременным).
В результате нормальный немутантный генотип получал мутацию.
Фенокопии появляются в большинстве случаев при действии внешней среды на ранних стадиях эмбриогенеза, что приводит к врожденным заболеваниями порокам развития.
Наличие фенокопий затрудняет диагностику заболеваний.
Дата публикования: 2015-01-26; Прочитано: 3805 | Нарушение авторского права страницы
studopedia.org — Студопедия.Орг — 2014-2018 год.(0.003 с)…
Экспрессивность (expressivity)
Экспрессивность (expressivity): не одинаковое проявление признака у индивидуумов, которые проявляют этот признак; степень фенотипического проявления мутации.
Примером может служить проявление мутации Lobe , изменяющей глаза у дрозофилы. Мутация доминантна, но если сравнивать гетерозиготные индивидуумы, то, несмотря на одинаковый генотип, ее проявление очень различно — от полного отсутствия глаз до больших глаз почти дикого типа.
В промежутке встречаются индивидуумы со всеми возможными вариантами глаз. Это случай вариабельной экспрессивности. В простейшем случае можно говорить о сильном и слабом проявлении признака, если аллель, кодирующий этот признак пенетрантен. Пенетрантность является качественной характеристикой, учитывающей только проявление или непроявление признака. Экспрессивность учитывает количественную сторону проявления признака, если он проявился.
Экспрессивность отражает характер и тяжесть симптомов, а также возраст начала заболевания.
Наглядный пример такой изменчивости — МЭН типа I .
У больных из одной семьи с одной мутацией может быть гиперплазия или неоплазия как одной, так и всех эндокринных тканей, включая поджелудочную железу, паращитовидные железы, гипофиз, а также жировую ткань. В итоге клиническая картина болезни чрезвычайно разнообразна: у больных из одной семьи можно обнаружить язвенную болезнь, гипогликемию, мочекаменную болезнь или опухоли гипофиза.
5.8. Экспрессивность и пенетрантность. Генокопии
Иногда при доминантных болезнях, для которых характерно образование опухолей, различия в экспрессивности обусловлены дополнительными мутациями в генах-супрессорах опухолевого роста.
Такие болезни, как болезнь Гентингтона и поликистоз почек, проявляются в разном возрасте, часто только у взрослых, несмотря на то, что мутантный ген у больных присутствует с самого рождения.
До конца не ясно, следует ли считать непостоянство возраста начала болезни результатом изменчивой экспрессивности. С одной стороны, для доказательства неполной пенетрантности необходимо полное обследование членов семьи и наблюдение на протяжении всей их жизни.
С другой стороны, отсутствие проявления можно рассматривать как минимальную экспрессивность гена.
Если человек, страдающий доминантной болезнью, хочет знать, насколько тяжело будет протекать болезнь у его ребенка, унаследовавшего мутацию, то он ставит вопрос об экспрессивности. С помощью генодиагностики можно выявить мутацию, даже не проявляющуюся, но нельзя предсказать диапазон экспрессивности мутации в данной семье.
Изменчивая экспрессивность, вплоть до полного отсутствия проявления гена, может быть обусловлена:
— влиянием генов, расположенных в том же или в других локусах;
— воздействием внешних и случайных факторов.
Например, тяжесть наследственного овалоцитоза, вызванного дефектом альфа-спектрина, зависит от степени экспрессии гена. У гетерозигот низкая экспрессия мутантного аллеля облегчает заболевание, а гомологичного аллеля (транс-аллеля) — усугубляет его.
При муковисцидозе тяжесть проявления мутации R117H (замены аргинина на гистидин в положении 117 белка-регулятора мембранной проводимости) зависит от цис-действия полиморфизма в сайте сплайсинга, который определяет концентрацию нормальной мРНК.
Гены, расположенные в других локусах, тоже влияют на проявление мутации. Так, тяжесть серповидноклеточной анемии зависит от генотипа локуса альфа-цепей глобина, а моногенных гиперлипопротеидемий — от генотипа нескольких локусов.
Тяжесть моногенных гиперлипопротеидемий, порфирий и гемохроматоза зависит от режима питания, потребления алкоголя, курения и физической нагрузки. Пример влияния случайных факторов — разная степень тяжести и распространенности поражений у однояйцевых близнецов с ретинобластомой, нейрофиброматозом или туберозным склерозом.
Случайные факторы определяют различия в инактивации Х-хромосомы у однояйцевых гетерозиготных девочек-близнецов при Х-сцепленном заболевании или генные перестройки и мутации при созревании генов иммуноглобулинов и антигенраспознающих рецепторов Т-лимфоцитов.
Хотя обычно говорят о пенетрантности и экспрессивности аутосомно-доминантных болезней, эти же принципы применимы при хромосомных, аутосомно-рецессивных, Х-сцепленных и полигенных болезнях.
Ссылки:
Эти понятия впервые введены в 1926 г. Н.В. Тимофеевым Рессовским и 0. Фогтом для описания варьирующего проявления признаков и контролирующих их генов. Экспрессивность есть степень выраженности (варьирования) одного и того же признака у разных лиц, имеющих ген, контролирующий данный признак. Наблюдается низкая и высокая экспрессивность. Рассмотрим, например, разную выраженность ринита (насморка) у трех разных больных (А, Б и С) с одним и тем же диагнозом 0РВИ.
У больного А ринит выражен в легкой степени («шмыгание носом»), позволяющей в течение дня обходиться одним носовым платком; у больного Б ринит выражен в средней степени (ежедневно 2-3 носовых платка); у больного С — высокая степень выраженности ринита (5-6 носовых платков).
Когда говорят об экспрессивности не отдельно взятого признака, а заболевания в целом, врачи часто оценивают состояние больного как удовлетворительное или средней степени тяжести, или как тяжелое,
в данном случае понятие экспрессивности аналогично понятию «тяжесть течения болезни».
Пенетрантность — это вероятность проявления одного и того же признака у разных лиц, имеющих ген, контролирующий данный признак. Пенетрантность измеряется в проценте лиц с определенным признаком от общего числа лиц, являющихся носителями гена, контролирующего данный признак.
0на бывает неполной или полной.
Примером заболевания с неполной пенетрантностью служит все тот же ринит при 0РВИ. Так, можно считать, что у больного А нет ринита (но есть другие признаки заболевания), тогда как у больных В и С ринит есть.
7 . Типы наследования признаков, их характеристика. Экспрессивность и пенетрантность.
Поэтому в данном случае пенетрантность ринита составляет 66,6%.
Пример заболевания с полной пенетрантностью — аутосомнодоминантная хорея Гентингтона (4р16). 0на манифестирует преимущественно у лиц в возрасте 31-55 лет (77% случаев), у остальных же больных — в другом возрасте: как в первые годы жизни, так и в 65, 75 лет и более. Важно подчеркнуть: если ген этой болезни передан потомку от одного из родителей, то болезнь проявится обязательно, в чем заключается полная пенетрантность.
Правда, пациент не всегда доживает до манифестации хореи Гентингтона, умирая от другой причины.
Генокопирование и его причины
Генокопии (лат.
genocopia
) - это сходные фенотипы, сформировавшиеся под влиянием разных неаллельных генов.
Ряд сходных по внешнему проявлению признаков, в том числе и наследственных болезней, может вызываться различными неаллельными генами. Такое явление называется генокопией.
Биологическая природа генокопий заключается в том, что синтез одинаковых веществ в клетке в ряде случаев достигается различными путями.
В наследственной патологии человека большую роль играют также фенокопии — модификационные изменения.
Они обусловлены тем, что в процессе развития под влиянием внешних факторов признак, зависящий от определенного генотипа, может измениться; при этом копируются признаки, характерные для другого генотипа.
То есть это одинаковые изменения фенотипа, обусловленные аллелями разных генов, а также имеющие место в результате различных генных взаимодействий или нарушений различных этапов одного биохимического процесса с прекращением синтеза.
Проявляется как эффект определенных мутаций, копирующих действие генов или их взаимодействие.
Один и тот же признак (группа признаков) бывает обусловлен разными генетическими причинами (или гетерогенностью). Такой эффект, по предложению немецкого генетика Х. Нахтхайма, получил в середине 40-х годов XX в.
название генокопирования. Известны три группы причин генокопирования.
Причины первой группы объединяет гетерогенность за счет полилокусности, или действия разных генов, расположенных в разных локусах на разных хромосомах. Например, среди наследственных болезней обмена сложных сахаров — глюкозоаминогликанов выделены 19 типов (подтипов) мукополисахаридозов. Все типы харак-
теризуются дефектами разных ферментов, но проявляются одной и той же (либо сходной) симптоматикой гаргоилического дисморфизма или фенотипа звонаря Квазимодо — главного героя романа «Собор Парижской Богоматери» классика французской литературы Виктора Гюго.
Схожий фенотип нередко наблюдается и при муколипидозах (нарушениях обмена липидов).
Другой пример полилокусности — фенилкетонурия. Сейчас выделены не только ее классический тип, обусловленный дефицитом фенилаланин-4-гидроксилазы (12q24.2), но и три атипичные формы: одна вызвана дефицитом дигидроптеридинредуктазы (4р15.1), а еще две — дефицитом ферментов пирувоилтетрагидроптерин-синтетазы и тетрагидробиоптерина (соответствующие гены пока не определены).
Дополнительные примеры полилокусности: гликогенозы (10 генокопий), синдром Эллерса-Данлоса (8), нейрофибраматоз Реклингаузена (6), врожденный гипотиреоз (5), гемолитическая анемия (5), болезнь Альцгеймера (5), синдром Барде-Бидля (3), рак грудной железы (2).
Причины второй группы объединяет внутрилокусная гетерогенность.
Она обусловлена либо множественным аллелизмом (см. главу 2), либо наличием генетических компаундов, или двойных гетерозигот, имеющих два одинаковых патологических аллеля в идентичных локусах гомологичных хромосом. Пример последнего — гетерозиготная бета-талассемия (11р15.5), формирующаяся в результате делеций двух генов, кодирующих бета-цепи глобинов, что ведет к повышенному содержанию гемоглобина HbA2 и повышенному (или нормальному) уровню гемоглобина HbF.
Причины третьей группы объединяет гетерогенность за счет мутаций в разных точках одного и того же гена.
Пример — муковисцидоз (7q31-q32), развивающийся из-за наличия почти 1000 точковых мутаций в гене, отвечающем за болезнь.
При общей длине гена муковисцидоза (250 тыс. н.п.) в нем предполагается обнаружить до 5000 таких мутаций. Данный ген кодирует белок, ответственный за трансмембранный перенос ионов хлора, что ведет к увеличению вязкости секрета экзокринных желез (потовых, слюнных, подъязычных и др.) и закупорке их протоков.
Другой пример — классическая фенилкетонурия, обусловленная наличием 50 точковых мутаций в гене, кодирующем фенилаланин-4- гидроксилазу (12q24.2); всего при этой болезни предполагается обнаружить более 500 точковых мутаций гена.
Большинство их возникает из-за полиморфизма по длине рестрикционных фрагментов (RFLP) или по числу тандемных повторов (VNTP). Установлено: главная мутация гена фенилкетонурии в славянских популяциях — R408 W/
Эффект плейотропии
Вышеупомянутая неоднозначность характера связей между генами и признаками выражается также в эффекте плейотропии или плейотропного действия, когда один ген вызывает формирование целого ряда признаков.
Например, ген аутосомно-рецессивной атаксии-телеангиэктазии, или синдрома Луи-Бар (11q23.2) ответственен за одновременное поражение не менее шести систем организма (нервная и иммунная системы, кожные покровы, слизистые оболочки органов дыхания и желудочно-кишечного тракта, а также конъюнктива глаз).
Другие примеры: ген синдрома Барде-Бидля (16q21) обусловливает слабоумие, полидактилию, ожирение, пигментную дегенерацию сетчатки; ген анемии Фанкони (20q13.2-13.3), контролирующий активность топоизомеразы I, вызывает анемию, тромбоцитопению, лейкопению, микроцефалию, аплазию лучевой кости, гипоплазию пястной кости I пальца, пороки развития сердца и почек, гипоспадию, пигментные пятна кожи, повышенную ломкость хромосом.
Выделяют первичную и вторичную плейотропию.
Первичная плейотропия обусловлена биохимическими механизмами действия мутантного белка-фермента (например, недостаточностью фенилаланин-4-гидроксилазы при фенилкетонурии).
Вторичная плейотропия обусловлена осложнениями патологического процесса, развившегося в результате первичной плейотропии.
Например, за счет усиленного кроветворения и гемосидероза паренхиматозных органов у больного с талассемией возникают утолщение костей черепа и гепатолиенальный синдром.
Многие генетические заболевания четко определяются в семье; т.е. аномальный фенотип легко отличить от нормального. Из клинического опыта, тем не менее, известно, что некоторые заболевания могут не проявляться, хотя человек имеет тот же генотип, который вызывает заболевание у других членов семьи. В других случаях одно и то же заболевание может иметь чрезвычайно вариабельное проявление с точки зрения клинической тяжести, диапазона симптомов или возраста начала.
Фенотипическая экспрессия аномального генотипа может модифицироваться эффектами старения, других генетических локусов или факторами окружающей среды. Различия в экспрессии могут часто приводить к трудностям в интерпретации диагноза и родословной. Есть два различных механизма, которые могут объяснить различия в экспрессии: пониженная пенетрантность и вариабельная экспрессивность.
Пенетрантность - вероятность того, что ген будет иметь любые фенотипические проявления. Если частота экспрессии фенотипа менее 100%, т.е. существуют лица, имеющие соответствующий генотип без каких-либо его проявлений, говорят, что ген имеет неполную пенетрантность. Пенетрантность - понятие типа «все или ничего». Это процент людей с патологическим генотипом и его проявлениями, хотя бы в некоторой степени.
Экспрессивность - тяжесть экспрессии фенотипа среди индивидуумов с одним патологическим генотипом. Когда тяжесть болезни различается у людей, имеющих тот же генотип, говорят, что фенотип имеет вариабельную экспрессивность. Даже в одной родословной два индивидуума, несущих те же мутантные гены, могут иметь некоторые одинаковые признаки и симптомы, а другие проявления болезни могут различаться в зависимости от пораженных тканей и органов.
Некоторые трудности в понимании наследования фенотипа болезни, возникающие вследствие возраст-зависимой пенетрантности и переменной экспрессивности, можно рассмотреть на примере аутосомно-доминантного нейрофиброматоза НФ1. Нейрофиброматоз 1-го типа - частое заболевание нервной системы, глаз и кожи, встречается приблизительно 1 на 3500 родов. Значимых различий в частоте болезни среди этнических групп нет.
Пример наследования нейрофиброматоза 1 типа - НФ1Нейрофиброматоз 1-го типа (НФ1) характеризуется ростом в коже многочисленных доброкачественных объемных опухолей, нейрофибром; присутствием многочисленных плоских нерегулярных пигментированных участков кожи, известных как «кофейные» пятна или пятна цвета «кофе с молоком»; ростом небольших доброкачественных опухолей (гамартом) в радужке глаза (узелков Лиша); иногда умственной задержкой, опухолями ЦНС, рассеянными плексиформными нейрофибромами и развитием злокачественных опухолей нервной системы или мышц. Таким образом, заболевание имеет плейотропный фенотип.
1-го типа (НФ1) впервые полностью описан врачом фон Реклингаузеном в 1882 г., но, вероятно, болезнь была известна с древних времен. Хотя взрослые гетерозиготы почти всегда имеют какие-нибудь признаки болезни (т.е. пенетрантность у взрослых 100%), некоторые могут иметь только «кофейные» пятна, веснушки в подмышечной области и узелки Лиша, тогда как другие могут иметь угрожающие жизни доброкачественные опухоли, затрагивающие спинной мозг или злокачественные саркомы конечностей.
Таким образом, существует вариабельная экспрессивность ; даже в пределах одной родословной некоторые больные поражены сильно, а другие только слегка. Постановка диагноза усложняется у детей, поскольку симптоматика развивается постепенно с возрастом. Например, в периоде новорожденности менее чем половина всех пораженных имеет хотя бы наиболее легкий признак болезни, «кофейные» пятна. Пенетрантность, следовательно, зависит от возраста.
В гене NF1 обнаружено множество различных мутаций, вызывающих снижение функции продукта гена, нейрофибромина. Приблизительно в половине случаев НФ1 вызван новой, а не унаследованной мутацией.
Главная генетическая проблема при консультировании семей пациентов с НФ1 - необходимость выбора между двумя равновероятными возможностями: болезнь пробанда спорадическая, т.е. новая мутация, или пациент унаследовал клинически значимую форму заболевания от родителя, у которого ген представлен, но слабо проявляет себя. Если пробанд унаследовал дефект, риск, что любой из его или ее сибсов также унаследуют это заболевание - 50%; но если пробанд имеет новую мутацию, риск для сибсов очень небольшой.
Важно, что и в том, и в другом случае риск того, что пациент передаст ген потомству , составляет 50%. Учитывая эту неопределенность, семьям пациентов с НФ1 нужно знать, что заболевание сможет быть обнаружено пресимптоматически и даже пренатально с помощью молекулярного генетического анализа. К сожалению, молекулярная диагностика обычно может только ответить на вопрос, будет ли развиваться заболевание, но не может определить степень его тяжести. За исключением ассоциации полной делеции гена с дисморфиями, умственной задержкой и большим количеством нейрофибром в раннем возрасте, корреляции между тяжестью фенотипа и конкретными мутациями в гене NF1 не выявлено.
Другой пример аутосомно-доминантного порока развития с неполной пенетрантностью - нарушение разделения кисти типа эктродактилии . Порок развития возникает на шестой или седьмой неделе развития, когда формируются кисти и стопы. Заболевание демонстрирует локусную гетерогенность. Выявлено по крайней мере пять локусов, хотя фактически ответственный ген подтвержден только в нескольких из них. Неполная пенетрантность в родословных с пороками развития кисти может привести к пропуску поколений, и это усложняет генетическое консультирование, поскольку человек с нормальными руками может, тем не менее, передавать ген заболевания и таким образом иметь больных детей.
Хотя в целом правила наследования моногенных заболеваний могут быть легко классифицированы на аутосомные или Х-сцепленные и доминантные или рецессивные, наследование в индивидуальной родословной может затемняться множеством других факторов, которые делают трудной интерпретацию вида наследования.
Диагностические трудности могут быть следствием неполной пенетрантности или вариабельной экспрессивности болезни; на экспрессию гена могут влиять другие гены и факторы окружающей среды; некоторые генотипы не доживают до рождения; может отсутствовать точная информация о присутствии заболевания у родственников или о семейных отношениях; доминантные и Х-сцепленные болезни могут вызывать новые мутации; и наконец, при небольшом размере семьи, типичным сегодня для большинства развитых стран, пациент может случайно оказаться единственным больным в семье, когда очень трудно принять решение о типе наследования.
Генетическое заболевание может появляться в любое время в течение всей жизни человека, начиная с раннего внутриутробного развития до старости. Некоторые из них могут быть летальными внутриутробно, другие могут создавать помехи для нормального развития плода и выявляться пренатально (например, ультрасонографией), но совместимы с живорождением; третьи могут быть выявлены только после рождения. (Часто путают генетические и врожденные заболевания.
Фенотипическое проявление информации, заключенной в генотипе, характеризуется показателями пенетрантности и экспрессивности. Пенетрантностъ отражает частоту фенотипического проявления имеющейся в генотипе информации. Она соответствует проценту особей, у которых доминантный аллель гена проявился в признак, по отношению ко всем носителям этого аллеля. Неполная пенетрантность доминантного аллеля гена может быть обусловлена системой генотипа, в которой функционирует данный аллель и которая является своеобразной средой для него. Взаимодействие неаллельных генов в процессе формирования признака может привести при определенном сочетании их аллелей к непроявлению доминантного аллеля одного из них.
В рассмотренных выше примерах (см. разд. 3.6.5.2) наличие в генотипе одного из генов в рецессивном гомозиготном состоянии не давало возможности проявиться доминантному аллелю другого гена (альбинизм, бомбейский феномен). Известны также случаи, когда фенотипическому проявлению определенного аллеля препятствуют факторы окружающей организм среды. Например, у китайской примулы развитие или отсутствие красной окраски цветков зависит от температуры и влажности воздуха: при t = 5-20°С - красные цветы, при t = 30-35°С и повышенной влажности - белые. У кроликов гималайской окраски темная пигментация шерсти, развивающаяся в обычных условиях лишь на отдельных участках тела, при выращивании их при пониженной температуре может быть получена на всем теле.
Экспрессивность также является показателем, характеризующим фенотипическое проявление наследственной информации. Она характеризует степень выраженности признака и, с одной стороны, зависит от дозы соответствующего аллеля гена при моногенном наследовании или от суммарной дозы доминантных аллелей генов при полигенном наследовании, а с другой - от факторов среды. Примером служит интенсивность красной окраски цветков ночной красавицы, убывающая в ряду генотипов АА, Аа, аа, или интенсивность пигментации кожи у человека, увеличивающаяся при возрастании числа доминантных аллелей в системе полигенов от 0 до 8 (см. рис. 3.80). Влияние средовых факторов на экспрессивность признака демонстрируется усилением степени пигментации кожи у человека при ультрафиолетовом облучении, когда появляется загар, или увеличением густоты шерсти у некоторых животных в зависимости от изменения температурного режима в разные сезоны года.
Антимутационные механизмы
В результате генных мутаций изменяется смысл биологической информации. Последствия этого могут быть двоякого рода. В условиях обитания, изменяющихся незначительно, новая информация обычно снижает выживаемость. При резкой смене условий существования, при освоении новой экологической ниши наличие разнообразной информации полезно. В связи с этим интенсивность мутационного процесса в природных условиях поддерживается на уровне, не вызывающем катастрофического снижения жизнеспособности вида. Важная роль в ограничении неблагоприятных последствий мутаций принадлежит антимутационным механизмам, возникшим в эволюции.
Некоторые из этих механизмов рассмотрены выше. Речь идет об особенностях функционирования ДНК-полимеразы, отбирающей требуемые нуклеотиды в процессе репликации ДНК, а также осуществляющей самокоррекцию при образовании новой цепи ДНК наряду с редактирующей эндонуклеазой. Подробно разобраны различные механизмы репарации структуры ДНК, роль вырожденности генетического кода (см. разд. 3.4.3.2). Решением этой задачи служит триплетность биологического кода, которая допускает минимальное число замен внутри триплета, ведущих к искажению информации. Так, 64% замен третьего нуклеотида в триплетах не дает изменения их смыслового значения. Правда, замены второго нуклеотида в 100% приводят к искажению смысла триплета.
Фактором защиты против неблагоприятных последствий генных мутаций служит парность хромосом в диплоидном кариотипе соматических клеток эукариот. Парность аллелей генов препятствует фенотипическому проявлению мутаций, если они имеют рецессивный характер.
Определенный вклад в снижение вредных последствий генных мутаций вносит явление экстракопирования генов, кодирующих жизненно важные макромолекулы. Оно заключается в наличии в генотипе нескольких десятков, а иногда и сотен идентичных копий таких генов. Примером могут служить гены рРНК, тРНК, гистоновых белков, без которых жизнедеятельность любой клетки невозможна. При наличии экстракопий мутационное изменение в одном или даже нескольких одинаковых генах не ведет к катастрофическим для клетки последствиям. Копий, остающихся неизменными, вполне достаточно, чтобы обеспечить нормальное функционирование.
Существенное значение имеет также функциональная неравнозначность замен аминокислот в полипептиде. Если новая и сменяемая аминокислоты сходны по физико-химическим свойствам, изменения третичной структуры и биологических свойств белка незначительны. Так, мутантные гемоглобины HbS и НЬС человека отличаются от нормального гемоглобина НЬА заменой в 6-м положении р-цепи глутаминовой кислоты соответственно на валин или лизин. Первая замена резко изменяет свойства гемоглобина и приводит к развитию тяжелого заболевания - серповидно-клеточной анемии. При второй замене свойства гемоглобина изменяются в гораздо меньшей степени. Причиной этих различий является то, что глутаминовая кислота и лизин проявляют сходные гидрофильные свойства, тогда как валин - это гидрофобная аминокислота.
Таким образом, перечисленные механизмы способствуют сохранению отобранных в ходе эволюции генов и одновременно накоплению в генофонде популяции различных их аллелей, формируя резерв наследственной изменчивости. Последний определяет высокую эволюционную пластичность популяции, т.е. способность выживать в разнообразных условиях.
Под действием генов (экспрессией, выражением генов) понимают способность их контролировать свойства организмов или, точнее, синтез белков. Для действия генов характерен ряд особенностей, важнейшая из которых - их экспрессивность. Под экспрессивностью понимают степень фенотипической выраженности генов, т. е. «силу» действия генов, проявляющуюся в степени развития контролируемых ими признаков. Термин предложен Н.В. Тимофеевым-Ресовским (1900-1981). Экспрессивность генов не является постоянным свойством наследственности, ибо она очень вариабельна у растений, животных и у человека. Например, у людей проявляется по-разному такой признак, как способность ощущать вкус фенилтиокарбамида. Для одних это вещество является слишком горьким, для других его горечь кажется меньшей, что является результатом разной степени экспрессивности гена, контролирующего способность ощущать вкус этого соединения. Примером вариабельности экспрессивности генов является также экспрессивность доминантного гена, контролирующего ювенильную катаракту глаз человека. Экспрессия этого гена у разных индивидуумов варьируется от слабого помутнения хрусталика глаз до его полной непрозрачности.
С другой стороны, для действия генов у млекопитающих характерен так называемый геномный импринтинг, заключающийся в том, что два аллеля гена экспрессируются дифференциально, т. е. экс- прессируется только один аллель из двух аллелей (отцовского и материнского), унаследованный от родителей. Например, у человека ген инсулиноподобного фактора 2 нормально экспрессируется только из аллеля, унаследованного от отца, тогда как соседний с ним ген, кодирующий нетранслируемую РНК, экспрессируется только из аллеля, унаследованного от матери.
Важнейшей особенностью действия генов является также их пенетрантность, впервые описанная тоже Н.В. Тимофеевым-Ресовским. Под ней понимают частоту проявления того или иного гена, измеряемую частотой встречаемости признака в популяции. Это объясняют либо модифицирующим влиянием других генов, либо среды, либо совместным действием этих факторов. Учет природы экспрессивно-
сти и пенетрантности генов имеет большое практическое значение, особенно в медицинской генетике.
Организмы наследуют от своих родителей не признаки и не свойства, они наследуют гены. В соответствии с существующими представлениями действие генов через РНК приводит к образованию белков. Следовательно, белки являются конечными продуктами действия генов, результатом экспрессии генов. Другими словами, гены контролируют синтез белков. Поскольку гены представляют собой ДНК, то вопрос сводится к следующему: каким образом ДНК осуществляют свои функции в контроле синтеза белков? Ответ на этот вопрос состоит в том, что в ДНК заключена генетическая информация о синтезе белков, т. е. содержится генетический код, под которым понимают систему записи генетической информации о синтезе белков в молекулах ДНК. Реализация генетического кода происходит в два этапа, один из которых называют транскрипцией, второй - трансляцией. Поток информации идет по схеме ДНК -- РНК -- белок. Эта схема получила название центральной догмы биологии.
СТРУКТУРА И СВОЙСТВА ГЕНЕТИЧЕСКОГО КОДА
Структура генетического кода характеризуется тем, что он является триплетным, т. е. состоит из триплетов (троек) азотистых оснований, получивших название кодонов. Один кодон кодирует место одной аминокислоты в полипептидной цепи (табл. 13). Что касается свойств генетического кода, то он является неперекрывающимся, линейным, не имеющим пунктуации («запятых»), обеспечивающей свободные пространства между кодонами, и вырожденным.
Неперекрываемость генетического кода означает, что любое азотистое основание является членом только одного кодона. Ни одно азотистое основание не входит одновременно в два кодона. Например, в последовательности ААГАУАГЦА имеется три кодона ААГ, АУА, ГЦА, но не ААГ, АГА, ГАУ и т. д. (рис. 49).
Кодоны в виде триплетов азотистых оснований следуют без перерывов. Между кодонами нет свободных пространств.
Вырожденность кода связана с тем, что одна и та же аминокислота может кодироваться одновременно несколькими кодонами. Это распространяется на все аминокислоты, кроме метионина и триптофана, которым соответствуют одиночные кодоны. Наконец, транскрипция гена (считывание триплетов азотистых оснований)
начинается с фиксированного пункта гена и заканчивается также в фиксированном пункте.
Таблица 13. Генетический код
кодов | Антикдон | Аминокислота | Кодом | Антикодон | Аминокислота |
|
УУУ УУЦ УУА УУГ ЦУЦ ЦУУ ЦУА ЦУГ АУУ АУЦ ауа АУГ гуу ГУЦ ГУА ГУГ уш УЦУ УШ уцГ ЦЦУ ЦЦГ ГАА ГАГ УГУ УШ УГГ | ААГ Π ААГ J аад -1 аац ГАГ ГАУ ГАЦ УАГ УАЦ ЦАГ ЦАУ ап АГУ пт ГГУ ЦУЕ ~ ЦУ5 АЦГ 2 АЩД | Фенклалвнин Лейцин Иаолейцин Мотионин Вялня Серкн Пролин Глдоамияоаая кислота Цнстенн Триптофан | АЦУ АЦЦ АЦА АЦГ ГЦУ пш гца ШГ УАУ УАЦ УАА~| УАГ УГА J цау ЦАЦ цаа цаг ААУ аац АЛА ААГ ГАУ ГАЦ цгу ЦГЦ цгл ШТ ΑΓΑ АГГ ГГУ ГШ ГГА ГГГ | УГУ J цп η цп ЦГУ J art] стоп гуд гуе] yyr ^j УУЯ "Ί УУЦ J цуг - ί ЦУД J ГШ пщ УЦУ _ ЦЦГ ЦЦУ шш | Треонин Алании Тироаин Пистндин Глютамнн Аспаралш Лиаии Аашрагинова* кислота Арпганв Глицин |
|
I - инозин (гипоксантиновый нуклеозид); R - псевдоуридин; V - 5-карбоксиметоксиуридин; Д - неидентифицированный дериват гуанозина; Е - 5-метолаланинометил-2-тиоуридин; S - 5-метоксикарбонилметил-2-тиоуридин; А - аденин; Ц - цитозин;
Г - гуанин
Рис. 49. Свойства генетического кода
ТРАНСКРИПЦИЯ
Мост между геном (кодонами) и белком обеспечивается РНК. Точнее, информация, закодированная в последовательности азотистых оснований ДНК, вначале переносится от ДНК к матричной РНК (мРНК). Этот этап переноса информации носит название транскрипции и происходит у прокариотов в нуклеоиде, а у эукариотов - в ядре.
Транскрипция - первый этап в передаче генетической информации, сущность которого заключается в синтезе мРНК, т. е. в «переписывании» генетической информации в молекулы мРНК. Основными структурами, которые участвуют в транскрипции, являются ДНКматрица (цепь ДНК), РНК-полимераза и хромосомные белки (гистоновые и негистоновые).
Однако наряду с молекулами мРНК с ДНК транскрибируются молекулы РНК и других видов (рибосомная и транспортная), также имеющие важное значение в реализации генетической информации. Все эти РНК называются еще ядерными. Размеры транскрибируемых молекул РНК зависят от посылаемых с цепи ДНК-шаблона сигналов начала и остановки синтеза (кодонов ини- циации и терминации).
Наиболее обильными РНК в клетках всех видов являются молекулы рибосомной РНК (рРНК), которые выполняют роль структурных компонентов рибосом. У эукариот синтез рРНК контролируется
огромным количеством генов (сотни копий) и происходит в ядрышке. В клетках человека гены для рРНК локализованы на 13, 14, 15, 21 и 22-й парах хромосом. Молекулы рРНК являются продуктами процессинга первичных транскриптов (прорРНК). В меньших количествах в клетках обнаруживаются молекулы транспортных РНК (тРНК), которые участвуют в декодировании информации (трасляции).
Молекулы мРНК составляют около 3% общей клеточной РНК, они очень нестабильны. Период их полужизни необычайно краток у прокариотов, составляя 2-10 мин. У эукариотов время полужизни молекул мРНК составляет несколько часов или даже несколько недель. У прокариотов молекулы мРНК - непосредственные продукты транскрипции. Напротив, у эукариотов они являются продуктами процессинга первичных РНК-транскриптов.
Синтез молекул мРНК происходит в ядре клетки, откуда через ядерную мембрану они проходят в цитоплазму к рибосомам. Он очень сходен с репликацией ДНК. Отличие заключается лишь в том, что в качестве матрицы (шаблона) для копирования цепи мРНК используется лишь одна цепь ДНК. При этом копирование мРНК может начаться с любого пункта одиночной цепи ДНК. Важно подчеркнуть, что какой-либо ген транскрибируется лишь с одной цепи. В то же время два даже соседних гена могут транскрибироваться с разных цепей. Таким образом, для транскрипции может использоваться любая из двух цепей ДНК. Одна из цепей транскрибируется одними РНК-полимеразами, другая - другими РНК-полимеразами. Поскольку обе цепи ДНК имеют противоположную полярность, то транскрипция на каждой из цепей проходит в противоположных направлениях. Цепь, которая содержит те же последовательности, что и мРНК, называют кодирующей, а цепь, обеспечивающую синтез мРНК (на основе комплементарного спаривания), - антикодирующей. Из-за считывания кода с мРНК для его записи используют основания А, Г, У, Ц.
В меньших количествах в клетках обнаруживаются молекулы транспортных РНК (тРНК), которые участвуют в декодировании информации (трансляции).
Молекулы тРНК также являются продуктами процессинга первичных транскриптов (см. ниже). Существенной особенностью тРНК служит свернутый характер их вторичной структуры, которая имеет форму клеверного листа (рис. 50).

Рис. 50. Вторичная структура молекулы фенилаланиновой тРНК
Все РНК транскрибируются с ДНК, которая несет множественные копии соответствующих генов. Механизм синтеза РНК сходен с меха- низмом репликации ДНК. Непосредственными предшественниками в синтезе РНК являются рибонуклеозидтри-фосфаты, причем здесь действует то же правило спаривания оснований, за исключением того, что кодируются лишь ограниченные сегменты цепи ДНК и что тимин в ДНК заменяется на урацил. Урацил спаривается с аденином таким же образом, как и тимин. Цепь РНК растет в направлении от 5"- к 3"-концу с освобождением пирофосфата (рис. 51).
Рис. 51. Транскрипция у эукариотов
Синтез РНК обеспечивается РНК-полимеразами. У прокариот синтез мРНК, рРНК и тРНК осуществляет лишь один тип РНК-полимеразы, количество молекул которой в клетках достигает 3000. Каждая из молекул этой РНК-полимеразы состоит из шести полипептидов, какими

являются субъединицы β и β" (м. м. 155 000 и 151 000 соответственно), двух субъединиц α м. м. 36 000 и еще двух низкомолекулярных субъединиц δ и ω, инициация транскрипции обеспечивается комплексом полимераза + белки (около 6 белковых комплексов). Связывание РНК-полимеразы с ДНК происходит на участке, называемом промотором. У Е. coli промоторы содержат последовательность ТАТААТ (бокс Прибнау), а контролируются белковым фактором (рис. 52).
Напротив, в клетках эукариот существуют три РНК-полимеразы, представляющие собой сложные молекулы, содержащие от одной до нескольких полипептидных цепей. Каждая из этих РНК-полимераз, прикрепляясь к промотору на ДНК, обеспечивает транскрипцию разных последовательностей ДНК. РНК-полимераза I синтезирует рибосомальную РНК (основные молекулы РНК больших и малых субъединиц рибосом). РНК-полимераза II синтезирует все мРНК и часть малых рРНК, РНК-полимераза III синтезирует тРНК и РНК 5/5"-субъединиц рибосом.
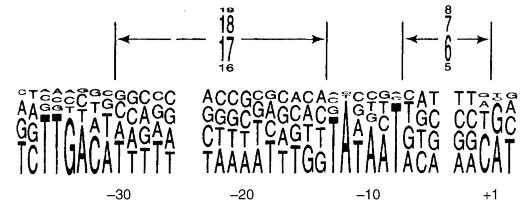
Рис. 52. Выбор промоторов
Эукариотические РНК-полимеразы также характеризуются сложным строением. РНК-полимераза II многих организмов построена из 12 различных полипептидов, три из которых гомологичны субъе- диницам β", β и α РНК-полимеразы из E. coli, РНК-полимеразы I и III обладают 5 субъединицами, сходными с субъединицами РНКполимеразы II. РНК-полимераза II инициирует транскрипцию, причем для этого требуется белок ДНК-геликаза, детерминируемая у дрожжей геном RA 25, а у человека - геном XRB.
Как отмечено выше, транскрипция у эукариот - более сложный процесс по сравнению с прокариотами. мРНК эукариотов образует-
ся в ядре из первичных генных транскриптов длиной 1000-500 000 пар оснований в результате процессинга (рис. 53). Другими словами, формируемые первичные транскрипты (про-мРНК) не на всем протяжении способны к трансляции. Для того чтобы про-мРНК стала «зрелой» мРНК, которая полностью транслируется, она еще в ядре вовлекается в процессинг, который заключается в том, что из промРНК «вырезают» нетранслируемые участки (интроны), после чего транслируемые участки (эксоны) воссоединяются (сплайсинг - процессинг). В результате образуются непрерывные последовательности, т. е. молекулы «зрелой» мРНК, которые по своим размерам значительно меньше молекул про-мРНК. Биологические механизмы сплайсинга определяются участием в этом процессе малых ядерных рибонуклеопротеиновых частиц, которые концентрируются в интерфазном ядре совместно с рибонуклеопротеидными факторами сплайсинга. Внутриклеточное распределение факторов сплайсинга контролируется одной из киназ. Четыре реакции процессинга РНК катализируются РНК-энзимами (рибозимами).
Помимо модификации ядерной про-мРНК путем «вырезания» и сплайсинга ее сегментов, изредко имеет место так называемое «редактирование» РНК, которое заключается в конверсии одного основания в другое. Например, в клетках печени синтезируемый белок аполидопротеин имеет молекулярную массу порядка 242 000 дальтон. Это результат конверсии в кодирующем гене цитозина в урацил (в клетках кишечника), что ведет к образованию стоп-
Рис. 53. Процессинг РНК

кодона и, следовательно, более короткого белка. Наконец, возможна модификация РНК и путем посттранскрипционного добавления к 3"-концу 30-50 нуклеотидов полиадениловой кислоты на расстоянии 15 нуклеотидов от последовательности ААУААА. По этой причине транскрипция заканчивается вдали от полиА-сигнала, а процессинг удаляет экстрануклеотиды до полиА-добавления.
Синтезированная «зрелая» мРНК является первичным продуктом действия генов и идет затем из ядра в цитоплазму, где служит матрицей для формирования полипептидных цепей на рибосомах. Считают, что в клетках имеется по 2000-3000 молекул мРНК, находящихся на разных уровнях синтеза и распада. В частности, установлены рибозимы с полинуклеотидкиназной активностью, способные катализировать АТФ-зависимое фосфорилирование.
Большинство эукариотических промоторов содержит ТАТАпоследовательность, локализованную на расстоянии 30 оснований от сайта транскрипционного старта. Инициация транскрипции обеспечивается совместным действием полимеразы и 6 дополнительных белков.
Установление интронов поставило вопрос об их происхождении. В объяснении происхождения используют две гипотезы. В соответ- ствии с одной гипотезой интроны были представлены уже в предковых генах, в соответствии с другой - интроны были включены в гены, которые оригинально были непрерывными.
Наряду с описанной транскрипцией у некоторых РНК-овых вирусов известна обратная транскрипция, при которой матрицей для синтеза ДНК является РНК и которая осуществляется ферментом, получившим название обратной транскриптазы (ревертазы).
Здесь информация идет по схеме РНК -- ДНК -- белок. Как свидетельствуют исследования, обратная транскриптаза найдена как у прокариотов, так и эукариотов. Считают, что ревертаза имеет очень древнее происхождение и существовала еще до разделения организмов на прокариоты и эукариоты.
ТРАНСЛЯЦИЯ
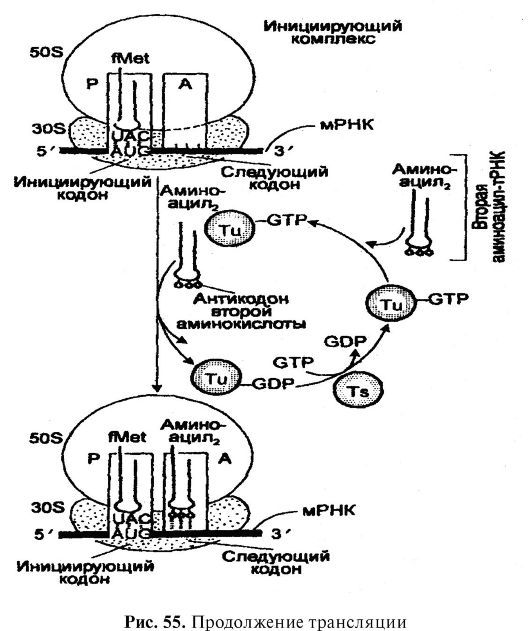
Трансляция - важная составная часть общего метаболизма, и ее сущность заключается в переводе генетической информации с мРНК, являющейся первичным продуктом действия генов, в аминокислотную последовательность белков (рис. 54). Трансляция
происходит в цитоплазме на рибосомах и представляет собой очень сложный, но центральный процесс в синтезе белков, в котором помимо рибосом участвуют мРНК, 3-5 молекул рРНК, 40-60 молекул разных тРНК, аминокислоты, около 20 ферментов (аминоацилтРНК синтетаз), активирующих аминокислоты, растворимые белки, вовлекаемые в инициацию, элонгацию и терминацию полипептидной цепи.

Рис. 54. Трансляция
Рибосомы состоят наполовину из белка и наполовину из рРНК (по 3-5 молекул на каждую рибосому). Размеры рибосом выражают в единицах скорости седиментации при центрифугировании У прокариотов размеры рибосом составляют 70 S, у эукариотов - 80 S. Рибосомы построены из пары субъединиц (большой и малой), которые диссоциируют по завершении трансляции мРНК. У Е. coli большая субъединица (50 S) содержит две молекулы рРНК (5 S и 23 S) и 30 полипептидов, тогда как малая субъединица (30 S) - одну молекулу рРНК (16 S) и 19 полипептидов. У эукариотов большая
субъединица содержит три разные молекулы рРНК (5 S, 5,8 S и 28 S) тогда как малая субъединица - одну молекулу рРНК (18 S).
Транспортные (адапторные, растворимые) РНК являются малыми (5 S) молекулами длиной 75-80 нуклеотидов. Нуклеотиды тРНК построены из остатка фосфорной кислоты, углеродной части (рибозы) и основания. Основные нуклеотиды тРНК - адениловый, гуаниловый, цитидиловый и уридиловый. Вместе с тем одна из особенностей структуры тРНК заключается в том, что все они содержат по нескольку необычных, так называемых минорных нуклеотидов, причем последние являются химическими модификациями аденилового, гуанилового, цитидилового и уридилового нуклеотидов (в основном в виде метилированных птуринов или нуклеотидов, обладающих метилированной рибозой). Некоторые из этих минорных нуклеотидов находятся в одном и том же районе у разных тРНК. тРНК присоединяют к себе свободные аминокислоты и переносят (включают) их в формирующиеся цепи полипептидов. Каждая тРНК способна присоединять и переносить только одну аминокислоту, но на каждую аминокислоту приходится 1-4 молекулы тРНК.
Все тРНК характеризуются специфической последовательностью нуклеотидов. Они содержат триплеты нуклеотидов, называемые антикодонами, которые комплементарны кодонам мРНК. Антикодоны располагаются в центре тРНК. Известно 55 антикодонов.
Первый этап трансляции происходит в цитоплазме и заключается в комбинировании каждой аминокислоты с АТФ и специфическим ферментом аминоацил-тРНК-синтетазой. В результате этого уста- навливается связь между фосфатом и карбоксильной группой аминокислоты (-Р-О-С), которая приводит к образованию комплексов, состоящих из аминокислоты, АМФ и специфического фермента. Пирофосфаты в процессе образования этих комплексов удаляются (рис. 55).
Второй этап трансляции осуществляется также в цитоплазме. Поскольку аминоацил-тРНК-синтетазы распознают аминокислоты и их тРНК, то второй этап состоит во взаимодействии образованных комплексов аминокислота-АМФ-специфический фермент (аминоацил-тРНК-синтетаза) со специфическими тРНК (один комплекс - одна тРНК). Поскольку цепи всех тРНК имеют одинаковую структуру концов (конечное основание - аденин, а два предыду- щих - цитозин и цитозин), то связывание одной аминокислоты со специфической тРНК происходит путем установления связи между
рибозой конечного нуклеотида (адениловой кислоты) и карбоксильной группой аминокислоты (-С-О-С-). Вследствие этого взаимодействия происходит формирование так называемых аминоацил-тРНК, представляющих собой комплексы аминокислоты со специфической тРНК, и освобождение в процессе образования этих комплексов АМФ и фермента (аминоацил-тРНК-синтетазы). Следовательно, аминоацил-тРНК являются прямыми предшественниками полипептидного синтеза на рибосомах.
Осуществление этих двух этапов приводит к активации аминокислот. Одни синтетазы активируют 2"-гидроксил конечного основания тРНК, тогда как другие активируют З"-гидроксил, а некоторые
активируют и 2" - и 3" -гидроксилы. Однако эти различия не имеют значения, поскольку после освобождения аминоациальная группа на тРНК мигрирует взад и вперед.
Третий этап трансляции и заключается в декодировании мРНК. Он осуществляется на рибосомах и в нем участвуют как мРНК, так и различные аминоацил-тРНК. После того как мРНК отошла от ДНК и прошла через ядерную мембрану в цитоплазму, она прикрепляется к РНК-последовательности, меньшей 30 S-субъединицы рибосомы. Последовательность мРНК, которая связывается с последовательностью рРНК рибосомной субъединицы 30 S, получила название рибосомосвязывающего сайта или последовательности Шайно - Дальгарно. Между тем каждая рибосома имеет два сайта, связывающих тРНК. Сайт А, или аминоацильный (акцепторный) сайт, связывает приходящую аминоацил-тРНК, которая несет аминокислоту, предназначенную для добавления в растущую полипептидную цепь рядом с ранее добавленной аминокислотой. Сайт Р, или пептидный (донорный) сайт, связывает пептидил-тРНК, к которой прикреплен растущий полипептид. Специфичность связывания аминоацил-тРНК в этих сайтах обеспечивается кодонами мРНК, которые составляют часть сайтов А и Р. Это связывание происходит благодаря водородным связям, устанавливаемым между определенными основаниями (антикодоном) каждой аминоацил-тРНК и основанием (кодоном) соответствующей последовательности мРНК. Первое и второе основания кодона всегда спариваются с третьим и вторым (соответственно) основаниями антикодона, тогда как третье основание кодона, если оно является урацилом, спаривается с гуанином или гипоксантином антикодона, если же оно является аденином - то с гипоксантином антикодона, а если гуанином - то с урацилом антикодона. Как уже отмечено, в обеспечении взаимодействия мРНК с тРНК участвует
рРНК 16 S.
После связывания с мРНК аминоацил-тРНК помещают (включают) аминокислоты вдоль молекулы мРНК и последовательности, соответствующей последовательности триплетов азотистых оснований в мРНК. Наращивание полипептидной цепи обеспечивается тем, что при синтезе белка рибосомы (полисомы) движутся вдоль цепи мРНК. Одновременно происходит формирование пептидных связей, обеспечиваемое несколькими ферментами-трансферазами, один из которых катализирует одновременно связывание аминоацил-тРНК с рибосомой, происходящее в присутствии ГТФ как кофактора. Каждая
пептидная связь образуется ковалентным связыванием атома углерода карбоксильной группы первой аминокислоты с аминогруппой второй аминокислоты. При этом в процессе связывания происходит открепление тРНК первой аминокислоты от углерода карбоксильной группы своей аминокислоты. Каждая вновь добавляемая аминокислота встает на место, следующее за аминокислотой, добавленной ранее. Как видно, полипептидная цепь наращивается с карбоксильного конца, а аминокислоты добавляются последовательно. Трансляция осуществляется в направлении от 5" - к 3" -концу полипептидного типа.
тРНК характеризуются исключительно высокой специфичностью, что проявляется в их антикодоновых последовательностях, соответствующих кодонам, доступности для распознания нужной аминоацил-тРНК-синтетазой и в точности связывания с сайтами А и Р на рибосомах.
Инициация, элонгация и терминация полипептидного синтеза находятся под генетическим контролем.
Наряду с кодонами, детерминирующими последовательность аминокислот, существуют кодоны, определяющие начало и конец чтения мРНК. В синтезе белка существенная роль принадлежит N-концевой аминокислоте формилметионину и его тРНК. N-формилметионин- тРНК (CHCNH-CH(CH 2 -CH 2 SCH 3)-СООтРНК) образуется в результате формилирования α-аминогруппы метионина NH 2 CH (CH 2 CH 2 SCH 3 CO)OH в метионил-тРНК. Поскольку формилирование характерно только для метионина и катализируется ферментом трансформилазой, то считают, что формилметионин-тРНК - инициатор синтеза полипептида. Это означает, что все полипептиды в процессе синтеза начинаются с метионина. VV-формилметионин является/У-концевой аминокислотой всех белков.
Инициация полипептидной цепи начинается с образования комплекса между мРНК, формилметионин-тРНК и рибосомной единицей 30 S, которое обеспечивается факторами (белками) инициации 1F1, 1F2 и 1F3, а также ГТФ. Этот комплекс вступает в комбинацию с 50^-рибосомной единицей, в результате чего формилметионинтРНК становится связанной с пептидиловым сайтом. Энергия для этого обеспечивается гидролизом одной молекулы ГТФ. Кодоны АУГ, ГУА и ГУГ на 5" -конце или рядом с ним направляют включение V -формилметионина в качестве V -концевой аминокислоты белка. Можно сказать, что эти кодоны являются специфическими инициаторами белкового синтеза. Наиболее активен кодон АУГ.
Элонгация (удлинение) полипептидной цепи обеспечивается факторами элонгации ef-ts и EF-Tu, а также гидролизом одной молекулы АТФ, а движение молекулы мРНК с одного сайта рибосомы на другой обеспечивается фактором элонгации EF-G и гидролизом одной молекулы ГТФ. Каждый раз мРНК движется на три нуклеотида. У бактерий частота элонгации составляет 16 аминокислот в секунду. Это означает, что рибосомы движутся вдоль мРНК со скоростью 48 нуклеотидов в секунду.
Терминация (окончание) синтеза детерминируется стоп-кодонами УАГ, УАА и УГА. Когда один из этих кодонов подойдет к А-сайту рибосомы, то полипептид, тРНК в Р-сайте и мРНК освободятся, а рибосомные субъединицы диссоциируют. Окончание синтеза белка связано с активностью белковых факторов - освобождения RF1 и RF2. Диссоциировав, рибосомные субъединицы начинают трансляцию другой молекулы мРНК. Большинство мРНК симультанно транслируется несколькими рибосомами (полисомами). Например, цепь гемоглобина из 150 аминокислот синтезируется на пентарибосомном комплексе. У прокариотов синтез и трансляция мРНК происходят в направлении от 5" -конца к 3" -концу. Далее, у них нет ядерной мембраны. Поэтому трансляция мРНК начинается еще до завершения ее синтеза. Напротив, у эукариотов транскрипция и трансляция разделены во времени, поскольку требуется время для перехода мРНК из ядра через ядерную мембрану в цитоплазму.
МИТОХОНДРИАЛЬНЫЙ ГЕНЕТИЧЕСКИЙ КОД
Помимо генетического кода, который содержится в ядерной ДНК, существует генетический код, находящийся в ДНК митохондрий. Можно сказать, что в результате наличия в митохондриальной ДНК кода в митохондриях существует самостоятельный аппарат синтеза белков.
Для митохондриального генетического кода характерны те же структура и свойства и механизмы транскрипции и трансляции, что и в случае ядерного генетического кода. Однако известны и специфические отличия. Митохондриальная ДНК человека и других млекопитающих содержит 64 кодона, из которых 4 являются стопкодонами. Размеры митохондриальных рибосом очень варьируют. В частности, размеры митохондриальных рибосом человека состав- ляют 60 S. Изучение трансляции митохондриального генетического
кода позволило выявить антикодоны для 22 тРНК, количество которых в 2,5 раза меньше по сравнению с ядерным кодом (табл. 14). Однако каждый антикодон в случае митохондриального генетического кода способен спариваться с несколькими кодонами. Например, антикодон УАГ спаривается с кодонами ЦУУ, ЦУЦ, ЦУА и ЦУГ, кодирующими лейцин. 22 антикодона тРНК спариваются с 60 кодонами мРНК.
Таблица 14. Антикодоны в митохондриальном генетическом коде млекопитающих*
ГАА | фенилаланин | ГУА тирозин |
|
УАА | лейцин | ||
УАГ | лейцин | ГУГ | гистидин |
ГАУ | изолейцин | УУГ | глютамин |
ЦАУ | метионин | ГУУ | аспарагин |
УАЦ | валин | УУУ | лизин |
УГА | серии | ГУЦ | аспарагиновая кислота |
УГГ | пролин | УУЦ | глютаминовая кислота |
УГУ | треонин | ГЦА | цистеин |
УГЦ | аланин | УЦА | триптофан |
УЦГ | аргинин |
||
ГЦУ | серин |
||
УЦЦ глицин |
|||
* Антикодон ГАА спаривается с кодоном УУУ и УУЦ, антикодон УАА - с кодонами УУА и УУГ, антикодон УАГ - с кодонами ЦУУ, ЦУЦ, ЦУА и ЦУГ и т. д., за исключением того, что антикодон ЦАУ спаривается с кодонами АУА и АУГ.
УНИВЕРСАЛЬНОСТЬ И ПРОИСХОЖДЕНИЕ
ГЕНЕТИЧЕСКОГО КОДА
Генетический код ядерной ДНК универсален, так как он одинаков у всех живых существ, т. е. у всех живых существ используются одинаковые наборы кодонов. Признание универсального характера генетического кода является выдающимся современным доказательством единства происхождения органических форм.
С тех пор как были определены основные черты структуры генетического кода, стали формулировать также гипотезы относительно
его эволюции, причем к настоящему времени известно несколько таких гипотез. В соответствии с одной гипотезой первоначальный код (в примитивной клетке) состоял из очень большого количества двусмысленных кодонов, что исключало правильную трансляцию генетической информации. Поэтому в процессе эволюции организмов развитие генетического кода шло по линии сокращения ошибок в трансляции, что привело к коду в его современном виде. Напротив, по другой гипотезе код возник в результате сведения до минимума летальных эффектов мутаций в процессе эволюции, причем селективное давление вело к устранению бессмысленных кодонов и к ограничению частоты мутаций в кодонах, изменения которых не сопровождались изменениями в последовательности аминокислот либо сопровождались заменами лишь одной аминокислоты на другую, но функционально связанную. Развившись в процессе эволюции, код однажды стал «замороженным», т. е. таким, каким мы видим его сейчас.
В соответствии с третьей гипотезой предполагают, что ранний архетиповой код был дуплетным, состоял из 16 кодонов-дуплетов. Каждый из 15 дуплетов кодировал каждую из 15 аминокислот, из которых, вероятно, состояли белки примитивной клетки, тогда как оставшийся свободным 16-й дуплет обеспечивал свободное пространство («брешь») между генами. Триплетный код появился тогда, когда в процессе эволюции образовались остальные 5 аминокислот, причем его возникновение связано с добавлением третьего основания в каждый кодон.
Предполагают, что современный генетический код является результатом длительной эволюции примитивного кода, кодировавшего лишь несколько аминокислот, притом только несколькими триплетами, составленными из азотистых оснований двух типов. В последующем эволюция кода заключалась в уменьшении количества бессмысленных триплетов и увеличении количества смысловых. Это привело к тому, что большинство триплетов стали «читаться». Завершающая стадия в эволюции кода была связана с увеличением количества аминокислот, подверженных «опознанию» соответствующими нуклеотидами (триплетами), а также с синтезом клетками соответствующих тРНК и активирующих ферментов. Когда количество и структура белков стали такими, что уже ни одна новая аминокислота не могла улучшить селективные преимущества организмов, код «заморозился» в его современном виде.
Что касается митохондриального кода, то его считают более примитивным по сравнению с ядерным. Предполагают, что, напри- мер, антикодон УАА в современном митохондриальном коде мог быть также и антикодоном архетипового кода для кодонов, в которых первые два основания являются У, а третье могло быть У, Ц, А или Г. Но можно предполагать, что митохондриальный код возник в результате упрощения в связи с происхождением митохондрий, особенностями белкового синтеза в последних.
Как видно, современные взгляды на происхождение и эволюцию кода пока противоречивы, ибо еще нет экспериментальных данных, которые можно было бы использовать для достаточного обоснования той или иной гипотезы.
МУТАЦИИ
Мутации (от лат. mutatio - перемена) - это изменения генов и хромосом, фенотипически проявляющиеся в изменении свойств и признаков организмов. Мутагенез - процесс образования мутаций во времени и пространстве.
Мутации характерны для всех живых существ, включая человека, у которого они сопровождаются наследственными болезнями. Мутантные организмы могут отличаться от исходных (организмов дикого типа) по самым различным свойствам - морфологическим, физиологическим, биохимическим и др. Например, у микроорганизмов мутации сопровождаются изменением формы колоний, питательных потребностей, отношения к лекарственным веществам и т. д. У насекомых мутанты отличаются от исходных организмов по форме и окраске тела, крыльев, конечностей, глаз, реакции на свет, серологическими свойствами и т. д. У человека мутации приводят к различным отклонениям от нормы и сопровождаются наследственной патологией (см. гл. VIII). Но важно помнить, что мутанты остаются организмом того же вида, что и организм дикого типа, из которого они произошли.
Мутации следует отличать от фенокопий, которые продуцируются факторами среды. Мимикрируя действие генов, они не передаются по наследству. Например, если беременных мышей экспонировать к пониженному атмосферному давлению, то некоторые из особей в пометах таких мышей будут иметь повреждения в мочеполовом тракте, но не передающиеся, однако, по наследству. В случае челове-
Мутации возникают на всех стадиях индивидуального развития организмов и поражают гены и хромосомы как в половых клетках, причем до оплодотворения и после оплодотворения (после первого деления оплодотворенных яйцеклеток), так и в соматических, причем в любой фазе клеточного цикла. Поэтому по типу клеток, в которых возникают мутации, различают генеративные и соматические мутации (соответственно).
Генеративные мутации происходят в генитальных и половых клетках. Если мутация (генеративная) осуществляется в генитальных клетках, то мутантный ген могут получить сразу несколько гамет, что увеличит потенциальную способность наследования этой мутации несколькими особями (индивидуумами) в потомстве. Если мутация произошла в гамете, то, вероятно, лишь одна особь (индивидуум) в потомстве получит этот ген. На частоту мутаций в половых клетках оказывает влияние возраст организма.
Соматические мутации встречаются в соматических клетках организмов. У животных и человека мутационные изменения будут сохраняться только в этих клетках. Но у растений из-за их способности к вегетативному размножению мутация может выйти за пределы соматических тканей. Например, знаменитый зимний сорт яблок «делишес» берет начало от мутации в соматической клетке, которая в результате деления привела к образованию ветки, имевшей характеристики мутантного типа. Затем следовало вегетативное размножение, позволившее получить растения со свойствами этого сорта.
По типу наследования различают доминантные, полудоминантные, кодоминантные и рецессивные мутации. Доминантные мутации характеризуются непосредственным влиянием на организм, полу- доминантные мутации заключаются в том, что гетерозиготная форма по фенотипу является промежуточной между формами АА и аа, а для кодоминантных мутаций характерно то, что у гетерозигот A 1 A 2 проявляются признаки обоих аллелей. Рецессивные мутации отсутствуют у гетерозигот.
Если доминантная мутация встречается в гаметах, ее эффекты выражаются непосредственно в потомстве. Многие мутации у человека являются доминантными. Они часты у животных и растений.
Например, генеративная доминантная мутация дала начало анконской породе коротконогих овец.
Примером полудоминантной мутации может служить мутационное образование гетерозиготной формы Аа, промежуточной по фенотипу между организмами АА и аа. Это имеет место в случае биохимических признаков, когда вклад в признак обоих аллелей одинаков.
Примером кодоминантной мутации являются аллели 1 А и 1 В, детерминирующие группу крови IV у человека.
В случае рецессивных мутаций их эффекты скрыты в диплоидах. Они проявляются лишь в гомозиготном состоянии. Примером служат рецессивные мутации, детерминирующие генные болезни человека.
Таким образом, к главным факторам в детерминировании вероятности проявления мутантного аллеля в организме и популяции относится не только стадия репродуктивного цикла, но и доминантность мутантного аллеля.
В зависимости от локализации в клетках различают генные (точечные) и хромосомные мутации (рис. 56).
I МУТАЦИИ I

Рис. 56. Классификация мутаций
Генные мутации заключаются в изменениях индивидуальных генов. Поэтому их еще называют точечными мутациями и классифицируют на односайтовые и многосайтовые. Односайтовая мутация затрагивает один сайт, многосайтовая - несколько сайтов генного локуса. Некоторые сайты являются «горячими точками», так как в них происходят концентрированные мутации, что связано с наличием в нуклеотидных последовательностях модифицированных оснований. Последние подвергаются частому дезаминирова-нию, а это ведет к изменениям в последовательностях оснований (см. ниже).
Генные мутации классифицируют также на прямые и обратные (реверсивные), которые одинаково встречаются у организмов всех систематических групп.
Прямые мутации - это те, что инактивируют гены дикого типа, т. е. мутации, которые изменяют информацию, закодированную в ДНК, прямым образом, в результате чего изменение от организма исходного (дикого) типа идет к организму мутантного типа.
Обратные мутации представляют собой реверсии к исходным (диким) типам от мутантных. Эти реверсии бывают двух типов. Первые обусловлены повторными мутациями аналогичного сайта или локуса и их называют истинными обратимыми мутациями. Вторые реверсии представляют собой мутации в каком-то другом гене, которые изменяют выражение мутантного гена в сторону исходного типа, т. е. повреждение в мутантном гене сохраняется, но он как бы восстанавливает свою функцию. Такое восстановление (полное или частичное) фенотипа, вопреки сохранению первоначального генетического повреждения (мутации), получило название супрессии, а обратные мутации называются супрессорными (внегенными). Как правило, супрессия происходит в результате мутаций генов, кодирующих синтез тРНК и рибосом.
Большинство генов довольно устойчивы к мутациям, однако известны гены, которые мутируют очень часто.
Спонтанные замены азотистых оснований возникают в ДНК в результате «ошибок», совершаемых ДНК-полимеразой и сопровождающихся неправильным спариванием оснований. Одно из объяснений этой «ошибочности» было дано Д. Уотсоном и Ф. Криком еще в 1953 г. и сводится к признанию в ошибочном спаривании роли аутомерных форм (структур, в которых протон перешел на место, противоположное обычной водородной связи) естественных основа-
ний. Следовательно, структурные основы для мутаций в виде замен оснований обеспечивают таутомеры естественных оснований.
Хромосомные мутации связаны с изменениями числа и структуры хромосом.
Изменения в числе хромосом определяются добавлением или уменьшением всего набора хромосом, ведущим к полиплоидии или гаплоидии (соответственно), а также добавлением или удалением одной или больше хромосом из набора, что ведет к гетероплоидии или анеуплоидии (моносомии, трисомии и другим полисомиям), тогда как изменения в структуре хромосом определяются перестройками (аберрациями) их структуры.
Полиплоидия - это хромосомная мутация в виде увеличения числа полных гаплоидных наборов хромосом. У полиплоидов каждая хромосома представлена более чем двумя гомологами. Известны триплоидия (3я), тетраплоидия (4n), пентаплоидия (5и) и т. д. Наиболее часто полиплоидия встречается у растений, поскольку для них характерны гермафродитизм и апомиксис. Почти третья часть всех видов диких цветковых растений это полиплоиды. Типичными являются полиплоиды различных видов пшениц, у которых соматические числа 2n - 14, 28 и 42 при основном гаметном числе n = 7. К полиплоидам относят картофель, табак, белый клевер, люцерну и другие растения. Родственные виды, наборы хромосом которых представляют ряд возрастающего увеличения (кратного) основного числа хромосом, составляют полиплоидные ряды.
Полиплоиды, происходящие от диплоидных организмов аналогичного вида, называют автополиплоидами. Искусственные полиплоиды, полученные из гибридов диплоидных растений, относящихся к далеко отстоящим друг от друга видам, называют аллополиплоидами. В природе встречаются как автополиплоиды, так и аллополиплоиды, однако географическое распределение полиплоидов обычно отличается от распределения их диплоидных «родственников». Например, флора острова Шпицберген содержит очень высокий процент полиплоидных рядов, тогда как в других местах количество их меньше по сравнению с диплоидами. Полиплоидия растений имеет хозяйственную ценность (увеличенный размер плодов, большая сахаристость, лучшая сохранность и др.).
У животных полиплоидия очень редка. Она встречается у земляных червей, размножающихся партеногенетически (обнаружены полиплоидные ряды с основными числами 11, 16, 17, 18 и 19 хромо-
сом), у некоторых членистоногих, рыб и земноводных. В частности, она описана у морских креветок. Женские особи саламандр отдельных видов, которые имеют крупные эритроциты с ядрами, продуцируют триплоидные личинки с 42 хромосомами, тогда как саламандры с малыми ядерными эритроцитами продуцируют диплоидные личинки с 28 хромосомами. Все тихоокеанские лососевые рыбы являются полиплоидами.
Сирийский хомячок (Mesocricetius awantus), у которого 2п = 44, является аллополиплоидом, возникшим в результате естественной гибридизации между европейским хомяком (Cricetus 2п = 22), и хомяком, принадлежащим к одному из азиатских видов (Cricetus griseus, 2п - 24).
Полиплоидия встречается также у человека в пренатальном периоде развития. В частности, известно много сообщений об обнаружении триплоидии и тетраплоидии в клетках абортусов. Имеющиеся данные позволяют считать, что триплоидия встречается у 20% абортусов, а тетраплоидия - у 6% абортусов.
Редкость полиплоидии у раздельнополых животных, по-видимому, определяется тем, что она нарушает нормальные соотношения аутосом и половых хромосом в зиготах.
Кроме авто- и аллополиплоидии в соматических клетках ряда многоклеточных организмов установлена эндополиплоидия, харак- теризующаяся увеличением числа хромосом в покоящемся ядре (при отсутствии митиза). От полиплоидии следует отличать псевдополиплоидию отдельных растений и насекомых, возникающую в результате однократного или многократного деления компонентов генома, когда центромеры имеют диффузный характер.
Гаплоидия - это мутация в виде уменьшения всего набора хро- мосом. Найдена в основном также у растений свыше 800 видов (пшеница, кукуруза и др.). У животных она очень редка, у человека неизвестна.
Мутацию в виде нарушений нормального количества хромосом из-за добавления или удаления одной или больше хромосом в какой-то хромосомной паре называют гетероплоидией или анеуплоидией. Среди гетероплоидов известны полисомии, когда какая-либо пара хромосом становится трипликатом или более моносомии, когда хромосомная пара теряет один гомолог, и нулесомии, когда теряется вся хромосомная пара. Эти мутации широко распространены как у животных, так и растений. В частности, трисомии и моносомии обнаружены у человека, собак и других животных, а также
у многих плодовых, зерновых и овощных растений. Часто трисомии, как и моносомии, обнаруживают в клетках абортусов.
Мутации, поражающую структуры хромосом, называют хромосомными перестройками или чаще аберрациями. Среди мутаций, затрагивающих структуры хромосом, различают делеции, дубликации, инверсии и транслокации (рис. 57).

Рис. 57. Хромосомные аберрации: 1 - нормальная хромосома; 2 - делеция; 3 - дубликации; 4 - гетерозиготные транслокации; 5 - гетерозиготные инверсии; 6 - гомозиготные транслокации; 7 - гомозиготные инверсии. Центромеры показаны крупными темными зонами
Делеции представляют собой потери сегмента хромосомы, несущего один или несколько генов. Они являются наиболее частой и опасной для человека формой генетических макроповреждений. Большие
делеции заключаются в потере одного или нескольких генов и даже блоков генов. У гаплоидных организмов крупные делеции летальны. Эффект делеции у диплоидных организмов зависит от числа деле- тированных генов, количественных потребностей в продуктах пораженных генов, позиции генов среди функционально координированных генных групп и др. В диплоидных клетках или в организмах, гомозиготных по данной делеции, последняя летальна.
Дубликации (добавления) представляют собой добавления (удлине- ния) какого-либо сегмента хромосомы, несущего один или несколько генов, в результате того, что один и тот же сегмент хромосомы может быть повторен несколько раз. Это повтор может быть малым, касаясь одиночного гена, или большим, затрагивая большое количество генов. Дубликации часто безвредны для их носителей. Предполагают, что они способствуют формированию полигенов или являются способом введения новых генов в геномы. Некоторые дубликации, одна- ко, вредны и даже летальны (см. гл. VIII).
Инверсии заключаются в поворотах на 180? сегментов, освобож- дающихся в результате парных разрывов в хромосомах. Если инвентированный сегмент не содержит центромеру, эту мутацию называют парацентрической инверсией, если же такой сегмент содержит центромеру, такую мутацию называют перицентрической. Инверсии оказывают влияние на мейоз, что приводит к пониженной фертильности гибридов. Описаны отдельные наследственные аномалии, вызываемые этой мутацией (см. гл. VIII).
Транслокация - это обмен частями (сегментами) гомологичной и негомологичной хромосом, образованными разрывами по длине последних. Транслоцируемые сегменты могут иметь разные размеры - от небольших до значительных.
В зависимости от происхождения различают спонтанные и индуцированные генные и хромосомные мутации.
Спонтанными называют генные и хромосомные мутации, возникающие в нормальных (природных) условиях, на первый взгляд, без видимых причин, тогда как индуцированными называют те мутации, которые возникают в результате экспонирования клеток (организмов) к мутагенным факторам.
Спонтанные мутации возникают самопроизвольно и имеют случайный (ненаправленный) характер во времени и пространстве. Наиболее существенная особенность этих мутаций заключается в том, что они, вероятно, возникают в условиях природного радио-
активного фона Земли (космическое излучение, радиоактивные элементы на поверхности Земли, радионуклиды, инкорпорированные в организмы) в результате нормальных процессов, протекающих в клетках, в частности, в результате ошибок репликации, когда ошибочно включается какой-либо нуклеотид и при этом имеется недостаток в «редактирующем» механизме, что исключает коррекцию ошибок. Ошибки могут быть связаны также с химической нестабильностью нуклеотидов. Например, цитозин может быть дезаминирован в урацил, который затем распознается как тимин в течение репликации ДНК. Их частоты у организмов всех видов исключительно малы. Определение частот спонтанных мутаций организмов разных видов основывается на данных о средних частотах мутаций по многим сайтам и должно отражать все изменения в последовательностях оснований ДНК в исследуемом генетическом районе. При этом средние мутационные частоты должны определяться измерением прямых мутаций в пределах разных генов, которые очень чувствительны к мутациям, независимо от того, являются ли условия для организмов ограничивающими или селективными.
Частоту спонтанных мутаций определяют сравнением клеток или популяций организмов, обработанных и необработанных мута- геном. Если частота мутации в популяции повышается в результате обработки мутагеном в 100 раз, то считают, что лишь один мутант в популяции будет спонтанным.
Определенные к настоящему времени частоты мутаций на репликацию пары оснований и общие частоты точечных мутаций у разных организмов показаны в табл. 15.
Одни гены устойчивы к мутации, другие спонтанно мутируют чаще, третьи - так часто, что их носители являются мозаиками мутированных и немутированных генов. Есть гены, которые влияют на способ- ность к мутациям других генов. Такие гены называют мутаторными.
Индуцированными являются те мутации, которые возникают после обработки клеток (организмов) мутагенными факторами - физическими, химическими и биологическими. Большинство этих факторов либо прямо реагирует с азотистыми основаниями в молекулах ДНК, либо включается в нуклеотидные последовательности.
Среди физических мутагенов различают ионизирующую радиацию и ультрафиолетовое изучение (УФ), входящие в ту часть электромагнитного спектра, который содержит волны более короткие и с большей энергией, чем видимый свет (ниже 0,1 нм).
Таблица 15. Частоты мутаций разных организмов
Организм | Количество пар оснований на геном | Частота мутаций на репликацию пары оснований | Общая частота мутаций |
ФагТ4 | 1,8 ? 10 6 | 1,7 ? 10 -3 | 3,0 ? 10 -3 |
Е. coli | 4,5 ? 10 6 | 2,0 ? 10 -10 | 0,9 ? 10 -3 |
N. crassa | 4,5 ? 10 7 | 0,7 ? 10 -11 | 2,9 ? 10 -4 |
D. melanogaster | 2,0 ? 10 8 | 7,0 ? 10 -11 |
Ионизирующие излучения - это рентгеновское излучение (Х-лучи), протоны и нейтроны, а также α, β и γ-лучи, освобождаемые радиоактивными элементами изотопов (32 Р, 14 С, 3 Н, кобальт-90 и др.). Они обладают высокой энергией и могут проникать в ткани, в которых сталкиваются с атомами и вызывают освобождение электронов, оставляя позитивно заряженные свободные радикалы или ионы. В свою очередь, эти ионы сталкиваются с другими молекулами, вызывая освобождение дальнейших электронов. Поэтому вдоль трека каждого высокоэнергетического луча формируется стержень ионов, проходящий в живые ткани.
Мутагенный эффект ионизирующей радиации вызывается повышенной реактивностью атомов, присутствующих в ДНК. Ионизирующие излучения индуцируют генные мутации (транзиции, трансверсии, делеции, включения), а также хромосомные разрывы, сопровождающиеся транслокациями и другими аберрациями. В случае острого облучения человека погибает большинство сперматогоний, но сперматоциты выживают, в результате чего в первые 6 недель после облучения происходит снижение фертильности, за которым следует бесплодие (2-3 месяца). Должна быть обеспечена защита в течение нескольких недель до и после зачатия.
Большую опасность представляют рентгенодиагностика и рентгенотерапия брюшной полости и области таза. Поэтому зачатие в течение нескольких недель до и после облучения должно быть исключено.
Для человека удваивающаяся доза ионизирующего излучения по генным мутациям составляет 1 грей, по хромосомным аберрациям (транслокациям) - 0,15 грея. Характерной особенностью ионизирующего излучения является также то, что для него отсутствует пороговость в дозе, а также то, что оно обладает коммулятивным эффектом.
Ультрафиолетовое излучение характеризуется меньшей энергией, проникает только через поверхностные слои клеток животных и растений и не вызывает ионизации тканей. Мутагенные эффекты УФ-излучения также вызываются повышенной реактивностью атомов, присутствующих в молекулах ДНК. Оно не опасно для половых клеток человека, так как поглощается кожей. УФ-излучение способствует образованию в клетках кожи тиминовых димеров, мутагенный эффект которых заключается в том, что они вызывают мутации не прямо, а нарушением точности репликации ДНК.
Химическими мутагенами являются органические и неорганические кислоты, щелочи, перекиси, соли металлов, этиленамины, формальдегиды, фенолы, акридиновые красители, алкилирующие соединения, аналоги пуриновых и пиримидиновых оснований и др. В частности, известны аналоги оснований (5-бромурацил, 2-аминопурин), химические факторы которых изменяют структуру и спаривание оснований (азотистая кислота, нитрозогуанидин, метилметансульфат, этилметансульфанат, интеркалирующие агенты (акридин оранжевый, профлавин, этидиум бромид), агенты, изменяющие структуру ДНК (псорален, пероксиды) (форм. 9), Считают, что для действия химических мутагенов характерна пороговость. Одни химические мутагены действуют как на реплицирующуюся, так и покоющуюся ДНК, тогда как другие только на реплицирующуюся ДНК. Примером мутагенов, вызывающих изменения и в реплицирующейся, и в покоящейся ДНК, являются алкилирующие соединения (метилметансульфонат, этилметансульфонат, нитрозогуанидин) и азотистая кислота. К мутагенам, действующим на реплицирующуюся ДНК, относят аналоги азотистых оснований и акридиновые красители.
Многие химические мутагены нарушают мейоз, что приводит к нерасхождению хромосом, а также вызывают разрывы хромосом и генные мутации. Например, трипофлавин действует на все стадии развития половых клеток, нитрозогуанидин - перед мейозом, а тренинон - после мейоза.
Некоторые из химических немутагенных соединений становятся мутагенами, попав в организм, как, например, циклофосфамид.
Заслуживают внимания химические вещества, используемые в качестве лекарственных соединений. Так, после лечения алкили- рующими соединениями необходимо избегать зачатия в первые три месяца. Известны указания на мутагенность оральных химических

Формула 9
контрацептивов, а также некоторых соединений, входящих в косметические средства и в консерванты продуктов питания.
Биологическими мутагенами называются вирусы, которые вызывают хромосомные аберрации, а также транспозируемые генетиче- ские элементы, которые вызывают генные и хромосомные мутации.
В экспериментальной работе используют разные способы получения сайтонаправленных индуцированных мутаций. В частности, широко распространен мутагенез in vitro клонируемой ДНК. Для этого последнюю обрабатывают нуклеазами или химическими мутагенами. Кроме того, известны методы мутагенеза химически синтезируемой ДНК. Наконец, возможно получение в стволовых клетках хромосомных аберраций генно-инженерным методом.
От мутаций существенно отличается генетический импринтинг, при котором экспрессия гена зависит от родительского происхождения. Импринтинговые гены встречаются в районах хромосом с раз- личиями в аллелях. В отличие от мутаций генетический импринтинг изменяет регуляцию генов.
набора хромосом, ведущего к диплоидным гаметам. Нерасхождение у женщин отмечается в 80% случаев, а у мужчин - в 20% случаев, причем как в первом, так и во втором мейотическом делении.
Механизмы гетероплоидии связаны с разрывами хромосом или хроматид и заключаются в изменениях последовательности генных локусов на хромосомах. У человека трисомии объясняются нерасхождением хромосом как в первом, так и во втором мейотическом делении.
Молекулярные механизмы хромосомных мутаций нуждаются в дополнительных исследованиях.
Молекулярные механизмы генных мутаций заключаются в изменениях последовательности азотистых оснований в молекулах ДНК. Эти изменения происходят в результате замен, делеций (выпадений), включений и дупликаций оснований.
Изменения, связанные с заменой оснований, классифицируют на простые и перекрестные замены (табл. 16).
Таблица 16. Типы замен оснований
Исходное основание | Основание, занявшее место исходного | Тип замены |
Пурин | Другой пурин | Простая замена (транзиция) |
Пиримидин | Другой пиримидин | То же |
Пурин | Любой пиримидин | Перекрестная замена (трансверсия) |
Пиримидин | Любой пурин | То же |
Простые замены, или транзиции, заключаются в замене пурина на пурин и наоборот, а в двухцепочечной молекуле ДНК-пары А-Т на пару Г-Ц и наоборот. Транзиции осуществляются при репликации ДНК без изменения ориентации пурин-пиримидин в двухцепочечной молекуле.
Перекрестные замены, или трансверсии, связаны заменой в ДНК пурина на пиримидин и наоборот. Замещающий пиримидин спа- ривается с пурином, так что в двухцепочечной молекуле ДНК оказывается пара пиримидин-пурин вместо пары пурин-пиримидин. Следовательно, трансверсии приводят к новым ориентациям пар пурин-пиримидин и заключаются в замене в двухцепочечной молекуле ДНК пары А-Т на пару Ц-Г и наоборот; пары А-Т на пару Т-А и наоборот; пары Т-А на пару Г-Ц и наоборот, а также пары Г-Ц на пару Ц-Г и наоборот.
Спонтанные замены азотистых оснований происходят очень редко. Например, в соответствии с существующими расчетами у человека за год случается около 10-20 спонтанных замен оснований, причем одна замена может быть повторена на каждые 10 000 генов лишь 50 раз на протяжении времени в 1 млн лет. Можно полагать, что такая чрезвычайно низкая частота замен оснований в ДНК присуща как животным (млекопитающим), так и человеку.
Основания ДНК подвержены спонтанным структурным изменениям, называемым таутомеризацией, которая способна существовать в двух формах; например, гуанин может находиться в кетоили энольной формах (форм. 10).
Спонтанные замены азотистых оснований возникают в ДНК в результате «ошибок», совершаемых ДНК-полимеразой, и сопро- вождаются неправильным спариванием оснований. Одно из объяснений этой «ошибочности» было дано Д. Уотсоном и Ф. Криком еще в 1953 г. Оно сводится к признанию в «ошибочном спаривании» роли таутомерных форм (структур, в которых протон перешел на место, противоположное водородной связи) естественных оснований. Следовательно, структурные основы для мутаций в виде замен оснований обеспечивают таутомеры естественных оснований.
Транзиции индуцируются азотистой кислотой, которая вызывает окислительное дезаминирование аденина, цитозина и гуанина, содержащих свободные аминогруппы, в гипоксантин, урацил и ксантин соответственно. Поскольку дезаминирование сопровождается переходом аминооснования в кетонооснование, гипоксантин, например, подобно гуанину, будет спариваться с цитозином, т. е. в результате дезаминирования аденина в гипоксантин пара А-Т перейдет в пару Г-Ц. В случае дезаминирования цитозина в урацил пара Г-Ц перейдет в пару А-Т (форм. 11). Транзиции индуцируются также алкилирующими соединениями. Например, этилметансульфонат алкилирует гуанин и освобождает от него ДНК без нарушения ее сахарофосфатного каркаса. Следовательно, гуанин может быть заменен любым основанием, и это ведет не только к транзициям, но и трансверсиям.
Наконец, транзиции вызываются мутагенами, действующими на ДНК только в состоянии репликации. Например, 5-бромура- цилом, который является аналогом тимина и способен включаться в ДНК посредством замещения тимина. Наряду с нормальной способностью 5-бромурацила спариваться с аденином иногда возникает состояние, когда он действует не как тимин, а как цитозин,

что обеспечивает формирование водородных связей его не с аденином, а с гуанином. Эти «ошибки» спаривания происходят либо при включении 5-бромурацила в ДНК («ошибки» включения), либо
при репликации ДНК после его включения («ошибки» репликации). Следовательно, время «ошибок» определяет характер транзиции. «Ошибки» спаривания, индуцируемые 5-бромурацилом, ведут к транзициям от пары Г-Ц к паре А-Т и наоборот (от А-Т к Г-Ц). Подобные транзиции индуцируются также 2-аминопурином.

СН,
Формула 11
Замены оснований приводят к изменениям смысла кодонов, вследствие чего они приобретают способность кодировать другую аминокислоту (миссенс-мутации). Например, замена в триплете ГУА, содержащаяся в гене β-гемоглобина, урацила на аденин (трансверсия), сопровождается тем, что в цепи β-гемоглобина вместо валина оказывается глутаминовая кислота. Это ведет к превращению гемоглобина в новый вариант мутантного гемоглобина (например, типа Бристоль). В результате замен оснований возникают также нонсенсмутации, когда на измененных кодонах обрывается чтение информации гена (как правило, такими кодонами являются триплеты УАГ, УАА и УГА). Одновременно в результате замен образуются кодоны, сохраняющие исходный смысл.
Замены могут встречаться в интронах или в районах регуляции транскрипции, трансляции и сплайсинга.
Делеции и включения одного или нескольких азотистых оснований в нуклеотидных последовательностях ДНК могут быть ошиб- ками репликации ДНК или индуцироваться акридиновыми красителями. Такие изменения называют мутациями сдвига рамки, ибо они приводят к сдвигу «рамки чтения» кода гена. Включаясь между соседними основаниями, акридин оранжевый заставляет их «раздвигаться» на расстояние 6-8 А. Если акридин оранжевый присутствует в полинуклеотидной цепи-шаблоне, то результатом будет добавление основания в новую цепь в процессе репликации ДНК. Если же акридин оранжевый присутствует во время репликации, он может включиться в новую цепь вместо основания, маскируя противоположное основание в цепи-шаблоне, и затем выйти. Это приводит к тому, что вновь реплицированной цепи будет недоставать основания, т. е. она будет реплицирована с делецией по основанию. Делеции могут затрагивать несколько оснований. Например, делеции 15 нуклеотидов ведут к утрате в белке 5 аминокислот.
Дупликации (добавление) 1-2 оснований могут приводить также к мутациям со сдвигом «рамки чтения». Если дупликации происходят внутри гена, то «рамка считывания» кода нарушается на большом протяжении.
Особую форму молекулярных механизмов генных мутаций представляют повторы триплетных азотистых оснований. Наличие в молекулах ДНК повторов триплетов оснований сопровождается нарушениями нормального цикла репликации ДНКм аномальным синтезом белка (из-за повторов аминокислоты, кодируемой повторяющимся триплетом). Например, мутации гена, контролирующего белок хантингтон, недостаток которого у человека сопровождается болезнью Хантингтона, заключаются в резком увеличении повторов триплета ЦАГ.
Делеции и дупликации азотистых оснований представляют собой молекулярный механизм и мутации митохондриальной ДНК челове- ка. Установлено, что из мтДНК могут быть делетированы сегменты длиной около 5000 пар оснований.
Мутации могут изменять нормальный импринтинг. Импринтинг встречается во многих районах хромосом.
ВОССТАНОВЛЕНИЕ ПОВРЕЖДЕНИЙ ДНК
Мутагенные и летальные эффекты мутагенов обусловлены структурными повреждениями, которые они вызывают в молекулах
ДНК. Однако эти повреждения часто подвержены восстановлению. Процесс реконструкции повреждений ДНК называют восстановле- нием или репарацией ДНК.
Будучи чувствительными к тому или иному виду излучения, клетки реагируют на УФ-облучение тем, что в их ДНК образуются повреждения, главные из которых представляют собой фотохимические изменения в пиримидиновых основаниях, переходящие в пиримидиновые димеры, в частности в тиминовые. Последние образуются за счет ковалентно связанных соседних тиминовых оснований в одной и той же цепи молекулы посредством присоединения углерода к углероду. Помимо тиминовых димеров, в ДНК облученных клеток происходит формирование также цитозин-тиминовых и цитозин-цитозиновых димеров, однако частота их является меньшей. Димеризация фланкирующих оснований в гене сопровождается затруднением транскрипции. Она ведет также к мутациям. В результате этого клетка может погибнуть или подвергнуться малигнизации.
Один из механизмов восстановления повреждений ДНК действует у многих видов организмов, включая человека, и состоит в том, что экспонирование в видимом свете клеток, предварительно обработанных УФ-излучением, приводит к снижению летального эффекта в несколько раз, т. е. к реактивации функций облученных клеток. Это реактивирующее действие видимого света связано с расщеплением (мономеризацией) пиримидиновых димеров, причем этот процесс обеспечивается светозависимым фотореактивирующим ферментом
(рис. 58).
Другой механизм удаления димеров пиримидиновых оснований из ДНК облученных клеток получил название темновой репарации или вырезания - восстановления. Так же как и фотореактивация, он представляет собой ферментативный процесс, но более сложный, притом проходящий в темноте (рис. 59). Этот механизм заключается в том, что тиминовые димеры подвергаются «вырезанию» из цепи ДНК, в которой остаются «бреши», «залатываемые» восстановительным синтезом ДНК при участии ДНК-полимеразы и использовании противоположной цепи в качестве шаблона. Конечный этап в уда- лении пиримидиновых димеров из ДНК-облученных клеток путем «вырезания» и «залатывания» «брешей» состоит в смыкании вновь реплицированного участка ДНК с соседними поврежденными участками и «замазывании» сахарофосфатных скелетных связей посредством фермента ДНК-лигазы.

Рис. 58. Фотореактивация индуцированных УФ-излучением пиримидиновых димеров в присутствии видимого света
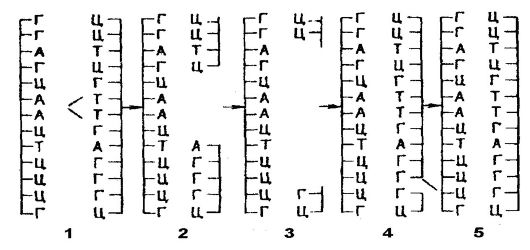
Рис. 59. Вырезание из ДНК пиримидиновых димеров, индуцированных
УФ-излучением: 1 - тиминовый димер; 2 - «брешь» в цепи; 3 - расширение «бреши»; 4 - заполнение «бреши» восстановительным синтезом; 5 - «замазывание» одноцепочечного разрыва Третий механизм восстановления повреждений ДНК называют пострепликационным или рекомбинационным восстановлением (рис. 60). Он заключается в том, что синтез ДНК в УФ-облученных клетках идет с нормальной скоростью вдоль хромосомы лишь до димера, перед которым замедляется на несколько секунд, после чего начинается вновь, но на другой стороне димера. Поскольку ДНКполимераза перескакивает через димер, то в дочерней цепи образуется «брешь». Вследствие этого район, содержащий димер в одном дуплексе, будет интактным в сестринском дуплексе, т. е. в дочерних
молекулах ДНК одна цепь содержит пиримидиновые димеры, тогда как в другой присутствуют бреши, которые фактически являются вторичными повреждениями. Следовательно, район, содержащий димеры в одном дуплексе, полностью сохраняется в сестринском дуплексе. Этот процесс заканчивается рекомбинацией вдоль молекулы ДНК после ее репликации, при которой дочерняя цепь, несущая в каком-либо участке «брешь», спаривается с другой дочерней цепью (комплементарной), несущей «брешь» в другом месте. Это спаривание позволяет провести восстановительный синтез, чтобы обеспечить восстановление правильной последовательности района в каждой бреши. В качестве шаблона используется соответствующий интактный район другой дочерней цепи. Рекомбинационные события на уровне каждой «бреши» приводят к реконструкции интактной молекулы ДНК, способной к дальнейшей репликации.

Рис. 60. Пострепликационное восстановление ДНК: 1 - поврежденное основание; 2 - точка репликации ДНК; 3 - «брешь»; 4 - рекомбинация между дочерними хромосомами; 5 - полное восстановление ДНК (но поврежденное основание сохраняется)
У человека известен синдром «ксеродерма пигментозум», который характеризуется чрезвычайной чувствительностью кожи к солнечному свету, в результате чего она подвергается избыточной пигмен- тации, а затем часто происходит и малигнизация кожных клеток. Возникновение этого синдрома связано с дефектом способности вырезать тиминовые димеры из ДНК. Известен также синдром Блума, заключающийся в повышенной чувствительности индивидов
к солнечному свету и связанный с повышением сестринских хроматидных обменов в их геномах. Этот синдром также связан с дефектом восстановления ДНК.
Нормально повреждения ДНК, индуцированные солнечным светом (УФ-компонентом), восстанавливаются «вырезанием- восстановлением».
Некоторые из потенциально летальных или вторичных повреждений, индуцируемых рентгеновским излучением, могут быть вос- станавливаемыми посредством рекомбинации или какого-либо другого механизма, в котором участвуют ферменты-рекомбиназы. Предполагается также, что в отличие от повреждений ДНК, индуцированных УФ-излучением, повреждения, индуцированные рентгеновским излучением, подвержены восстановлению (через рекомбинацию) еще до первой постлучевой репликации.
Повреждения, вызываемые в ДНК химическими мутагенами, также восстанавливаются с помощью того или иного механизма. Каждый из механизмов восстановления ДНК является, по существу, системой защиты ДНК. В то же время восстановление ДНК часто сопровождается ошибками, проявляющимися в форме мутаций.
Вопреки тому что ДНК является хранителем генетической информации, она обладает ограниченной химической стабильностью. В клетках с довольно высокой частотой встречаются гидролиз, окисление и неэнзиматическое метилирование ДНК. Эти реакции взаимодействуют с восстановлением ДНК. Предполагают, что спонтанный распад ДНК - главный фактор в спонтанном мутагенезе, карциногенезе и старости.
Вероятно, ДНК кодирует коррекцию собственных ошибок.
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ ЭКСПРЕССИИ ГЕНОВ
Сведения о регуляторных механизмах экспрессии генов по большей части получены в результате излучения самого простейшего образца контроля активности генов, каким является контроль, распространяемый на последовательность реакции в биосинтезе, осуществляемом микроорганизмами. Известно два механизма, один из которых контролирует активность ферментов, тогда как второй - синтезирует ферменты (синтез специфических белков).
Сущность контроля (регуляции) активности ферментов иллюстрируется примером биосинтеза изолейцина, ранним предше-
ственником которого является треонин и превращение которого в изолейцин осуществляется в результате пяти последовательных реакций с участием ферментов. Если к культуре бактерий, обладающих самостоятельной способностью синтезировать аминокислоты, в том числе изолейцин, прибавить изолейцин, это приведет к прекращению клетками синтеза данной аминокислоты. Ростовые потребности клеток в это время обеспечиваются лишь экзогенным изолейцином. Механизм этого явления заключается в ингибирова- нии (подавлении) активности фермента, катализирующего превращение треонина в последующий предшественник изолейцина. Синтез восстанавливается лишь тогда, когда экзогенный изолейцин истощается в среде.
Уникальность этого явления связана с тем, что ингибитор (конечный продукт) и нормальный субстрат имеют различную структуру и не конкурируют за один и тот же сайт связывания на ферменте. Можно сказать, что фермент несет два сайта связывания, один из которых специфичен для субстрата, другой - для ингибитора. Нормально субстрат прикрепляется к активному сайту фермента. Однако если к этому специфическому сайту прикрепляется ингибитор, то наступает структурное превращение (транзиция) в ферменте, вследствие чего нормальный субстрат больше не прикрепляется, что блокирует активность фермента, катализирующего конец биосинтеза, либо одну из его стадий. Это явление получило название аллостерической транзиции (рис. 61).
В основе аллостерического взаимодействия лежит любое изменение в активности фермента, вызываемое избирательным связыванием на втором сайте фермента, причем этот сайт не перекрывает сайта на ферменте для связывания субстрата. Фермент, по существу, становится химическим трансдуктором, позволяющим взаимодействие между двумя молекулами - ингибитором и субстратом, которое другим способом исключено. Определенные ферменты чувствительны к активированию при соединении их с эффекторной молекулой, отличной от каталитического субстрата. Кроме того, определенные ферменты чувствительны к активированию одним метаболитом и подавлению другим. Поскольку возможны мутации, которые могут поражать один ингибиторный сайт, не затрагивая другого, фенотипически они проявляются в резистентности клеток к ингибированию конечным продуктом и в выработке ими больших количеств конечного продукта. Таким образом, аллостерическая транзиция
обеспечивает исключительно гибкую систему регуляции активности ферментов.

Рис. 61. Аллостерический переход: а - активный фермент:
1 - активный центр фермента, к которому присоединяется субстрат 3;
2 - активный центр фермента, к которому присоединяется ингибитор 4;
б - неактивный фермент: 1 - измененный активный центр
Синтез ферментов регулируется с помощью индукции и репрессии ферментов, заключающихся в стимуляции или подавлении синтеза специфических ферментов как ответной реакции на добавление в среду компонента, повышающего концентрацию эффектора в клетке.
Примером индукции ферментов является случай с ферментами бактерий, обеспечивающих утилизацию лактозы. Бактерии приобретают способность сбраживать лактозу после некоторого культивирования в присутствии этого углевода. Это определяется синтезом ими β-галактозидазы, которая расщепляет лактозу или другой β-галактозид, а также β-галактозидпермеазы и β -галактозидтрансацетилазы, обеспечивающих проникновение субстрата в клетку. Следовательно, лактоза индуцирует синтез ферментов, причем этот синтез является координированным.
Примером репрессии ферментов может служить синтез триптофана, который образуется из антраниловой кислоты с участием антранилатсинтетазы. Если бактерии посеять в среду, в которой в качестве источника азота и углерода содержатся NH 4 Cl и глюкоза соответственно, то они очень хорошо растут и самостоятельно синтезируют триптофан (как и другие аминокислоты). Но если в среду добавить экзогенный триптофан, то бактерии перестают синтезировать эту аминокислоту. Важно заметить, что добавление триптофана
останавливает синтез всех ферментов, участвующих в его биосинтезе. Таким образом, конечный продукт подавляет весь биосинтез.
Опираясь на данные об индукции и репрессии белков, французские ученые Ф. Жакоб и Ж. Моно (1961) сформулировали модель генетического контроля синтеза белков; ее компонентами являются гены структуры, регуляции и операторные гены, а также цитоплазматический репрессор. По этой модели молекулярная структура белков определяется генами структуры, первичный продукт которых - мРНК. Синтез мРНК может быть начат лишь на определенном пункте цепи ДНК (оператора), от которого может зависеть и транскрипция нескольких сцепленных структурных генов. Группа генов, транскрипционная активность которых координируется одиночным оператором, представляет собой оперон, являющийся единицей первичной транскрипции и единицей координированной экспрессии генов. Существуют также гены-регуляторы. Под контролем того или иного гена-регулятора продуцируется цитоплазматический фактор-репрессор, который обладает реверсивной способностью связываться со специфическим оператором. Благодаря этому связыванию комбинация репрессора и оператора блокирует начало транскрипции всего оперона (формирование мРНК), контролируемой оператором, и, следовательно, предотвращает синтез белков, управляемый струк- турными генами, принадлежащими оперону.
Репрессор обладает свойством специфически связываться (реагировать) с малыми молекулами (эффекторами). В случае индуцибельных ферментных систем репрессор связывается с оператором и блокирует транскрипцию оперона. Присутствие эффектора (индуктора) связывает (инактивирует) репрессор, и это приводит к тому, что происходит транскрипция и трансляция генов оперона. Другими словами, репрессор, соединенный с эффектором, теряет родство к оператору и не связывается с ним, а это сопровождается активацией оперона. В случае репрессибельных ферментов репрессор сам по себе неактивен, т. е. не имеет родства к оператору и не блокирует транскрипцию оперона. Он активируется лишь в результате комбинации (соединения) с конечным продуктом в биосинтезе, в результате чего блокирует транскрипцию оперона. Следовательно, транскрипция оперона происходит в отсутствие эффектора (конечного продукта), тогда как присутствие эффектора сопровождается ингибированием оперона.
Регуляторные механизмы в случае индуцибельных и репрессибельных систем имеют негативный характер, так как подавляют
синтез специфических белков. Регуляторный механизм оперирует на генетическом уровне, контролируя частоту синтеза мРНК.
Опероны классифицируют на катаболизирующие (индуцибельные) и синтезирующие (репрессибельные). Примером катаболизирующих оперонов является лактозный оперон (рис. 62), в состав которого входят структурные гены z, у и а, кодирующие (β-галактозидазу, (β-пермеазу и (β-трансацетилазу соответственно ген-регулятор /, кодирующий синтез репрессора (белок м.м. 37 200, состоящий из четырех идентичных единиц, содержащих по 347 аминокислотных остатков), прото- мотр, к которому присоединяется РНК-полимераза, и ген-оператор, управляющий функционированием структурных генов. Механизм регуляции лактозного оперона заключается в том, что в отсутствие индуктора (лактозы) репрессор активен, т. е. связан с оператором, и это блокирует транскрипцию полигенной мРНК. При наличии в среде индуктора репрессор теряет активность, т. е. связывается
Рис. 62. Лактозный оперон и его регуляция
с индуктором, в результате чего оператор становится свободным (деблокируется) и происходит транскрипция мРНК. Следовательно, лактозный оперон контролируется негативно путем контроля часто- ты синтеза мРНК.
Однако возможна и позитивная регуляция лактозного оперона. Если вслед за индуктором в среду, где выращены бактерии, прибавить глюкозу, то наступает катаболитная репрессия β-галактозидазы, сопровождающаяся снижением уровня циклического АМФ. Если же в культуру прибавить экзогенный цАМФ, то катаболитная репрессия снимается и лактозный оперон будет функционировать нормально. Таким образом, цАМФ - это позитивный регулятор (регуляция происходит в присутствии индуктора).
Примером биосинтезирующего оперона является триптофановый оперон (рис. 63), экспрессия которого находится под негативным контролем репрессора - продукта гена trp R. Репрессия конечным про- дуктом заключается в том, что неактивный в свободном состоянии репрессор не мешает транскрипции мРНК. Репрессор становится активным в результате связывания с конечным продуктом. Когда комплекс репрессор + конечный продукт связывает оператор, то это сопровождается подавлением синтеза мРНК.
Генетический контроль синтеза белков у прокариотов происходит на уровне как транскрипции, так и трансляции и затрагивает процессы начиная с синтеза мРНК и заканчивая элонгацией полипеп- тидных цепей (рис. 64).

Рис. 63. Триптофановый оперон

Рис. 64. Катаболизм арабинозы
В геноме эукариотических клеток содержится очень много геноврегуляторов. Регулирующие белки, синтезируемые под контролем этих генов, связываются со специфической последовательностью ДНК вблизи регулируемых генов.
Для некоторых организмов - эукариотов (например, микроскопических грибов) - также характерна опероновая организация функционально связанных генов, однако в случае большинства эукариотов считают, что либо у них оперонов нет, т. е. эукариотические гены регулируются индивидуально, транскрибируясь в моноцистронные мРНК, либо эукариотические гены регулируются частично полицистронно, частично моноцистронно. В пользу второго предположения свидетельствуют данные об обнаружении у нематоды С. elegans генов, организованных в оперонах. У организмов этого вида процессинг полицистрон- ной мРНК в моноцистронную мРНК происходит до трансляции.
Считают, что генетический контроль синтеза белков у высших эукариотов осуществляется, как на уровне транскрипции (частота синтеза мРНК, процессинг мРНК, транспорт мРНК из ядра, стабильность мРНК), так и на уровне трансляции (частота трансляции,
регуляция синтеза белковых факторов, ответственных за инициацию, элонгацию и терминацию полипептидной цепи). Полагают также, что в генетической регуляции имеет значение структура хро- матина, которая блокирует доступ специфических активирующих белков (активаторов) к промоторам. Установлен в клетках эукариотов специфический комплекс, который обеспечивает АТФ-зависимое разрушение нуклеосом, позволяя при этом активаторам связываться с нуклеосомным стержнем, что ведет к транскрипции.
ЭВОЛЮЦИЯ ГЕНОВ
В историческом плане вопрос об эволюции генов является важнейшим, так как эволюция генов связана с истоками жизни вообще и ее совершенствованием в частности. Поскольку выявлена изначальная роль в происхождении жизни РНК, то предполагают, что начало эволюции генов датируется 3,5-3,8 млрд лет назад, когда сформировались первые молекулы РНК, которые каким-то образом детерминировали синтез белков, т. е. были первыми хранителями генетической информации. Однако, когда выявилась необходимость в повышении эффективности синтеза белков, способность кодирования генетической информации перешла к ДНК, которая стала главным хранителем генетической информации. Что касается РНК, то она оказалась между ДНК и белков, став «переносчиком» информации. Конечно, эта гипотеза не имеет доказательств. Тем не менее многие считают, что появление ДНК связано с усложнением структуры клеток и, следовательно, необходимостью кодирования большого количества информации по сравнению с РНК. Другими словами, с началом участия ДНК в хранении генетической информации стал развиваться генетической код.
В последнее время большое внимание приобрела гипотеза, в соответствии с которой источником новых генов является рекомбинация эксонов, а также транспозоны, поступающие в геномы организмов.
Особый интерес в эволюционном плане представляет ДНК, которая не транскрибируется (эгоистическая ДНК). Казалось, должны быть какие-то факторы контрселекции, которые обеспечивают поддержание этой ДНК в клетках. Между тем такие факторы неизвестны. Тем не менее очень популярно предположение, что эгоистическая ДНК тоже является источником образования новых генов.
В обсуждении направления эволюции геномов известно два объяснения. Одни ученые предполагают, что увеличение геномов клеток
в процессе эволюции организмов шло путем включения в ядерные структуры дополнительных копий генов, в то время как дру- гие считают, что в эволюции шла дупликация уже образованных генов с последующей их дивергенцией. Доказательства включения генов в геномы отсутствуют, тогда как предположение о дупликации и дивергенции генов имеет существенные обоснования, причем эти обоснования исходят из данных о том, что многочисленные семейства белков кодируются наборами родственных генов.
Установлено, например, что в кодировании яичного альбумина цыплят участвует несколько генов. Лейкоцитарный интерферон человека кодируется девятью неаллельными генами, а δ-кристаллин цыплят - двумя генами. Белок актин у насекомых и морских ежей контролируется тоже несколькими генами, причем для каждого актина в разных сократительных клетках существует свой ген. Белки хориона контролируются тоже несколькими генами, причем объединенными в сложный кластер. Идентифицировано несколько генов, кодирующих родопсины, обеспечивающие восприятие разных цветов. Наконец, иммуноглобулины также кодируются многими генами, например у мышей - тремя генами. Известны и другие примеры. Поэтому можно сказать, что синтез лишь нескольких белков контролируется одиночными генами. Например, одним геном кодируется синтез инсулина человека и кур. В подтверждение предположения о дупликации и дивергенции генов и, следовательно, о механизмах увеличения геномов наиболее показательны данные об эволюции мультисемейства генов, кодирующих гемоглобин.
У морских червей, некоторых насекомых и рыб размеры глобиновой молекулы, переносящей кислород, составляют всего лишь 150 аминокислотных остатков. У человека каждая молекула гемоглобина состоит из двух аполипептидных цепей и двух α-полипептидных цепей. Синтез гемоглобинов кодируется двумя несцепленными кластерами генов. Кластер α-глобиновых генов локализован на 16-й хромосоме и содержит два эмбриональных, а также два почти идентичных фетальных глобиновых гена. Второй кластер, располагающийся на хромосоме 11, кодирует β-глобины. Он состоит из β-глобинового гена, одного эмбрионального β-гена, двух фетальных генов, а также гена β-глобина.
Исходя из сведений о генетическом контроле глобинов и данных секвенирования глобиновых генов предполагают, что самая первая дупликация гена, контролирующего синтез белка, являющегося предшествен-
ником гемоглобина, произошла 1 млрд лет назад, дав начало паре генов. Один ген из этой пары в ходе эволюции стал геном, контролирующим синтез миоглобина, другой развился в ген, контролирующий синтез гемоглобина. В последующем (около 500 млн лет назад) ген гемоглобина вновь подвергся дупликации, в результате чего возникли гены, контролирующие синтез гемоглобиновых цепей α и β. Через некоторое время дальнейшей дупликации подвергся ген β-цепи, что дало начало гену гемоглобина, синтезируемого только в эмбриональном периоде. Далее ген эмбрионального гемоглобина подвергся тоже дупликации, что дало начало уже гемоглобинам ε и γ. Еще одна дупликация гена β-цепи дала ген, кодирующий синтез β-глобина. Таким образом, в результате серии тандемных дупликаций исходный глобиновый ген стал на одной из стадий развития кластерами генов α- и β-глобинов.
Эволюция генов ускоряется транспозируемыми элементами, которые обладают способностью наращивать геномы. Наконец, увеличению геномов способствует генетическая рекомбинация.
Один из принципиальных вопросов связан с познанием механизмов, предупреждающих гены от дупликации в результате транс- крипционной активации генов-«соседей». В последнее время на примере D. melanogaster показано существование пограничных сегментов (последовательностей) ДНК, функционально изолирующих соседние гены. Длина последовательностей-изоляторов составляет около 340 пар оснований. Не исключено, что такие последовательности существуют и у других организмов.
ВОПРОСЫ ДЛЯ ОБСУЖДЕНИЯ
1. На чем основаны представления о том, что генетическим материалом являются нуклеиновые кислоты? Каково значение в перечне доказательств генетической роли ДНК генной инженерии?
2. Существует ли связь между размерами генома (в количестве нуклеотидных пар) и видовой принадлежностью организма? Приведите примеры в обоснование вашей точки зрения.
3. Что вы знаете о путях увеличения генома клеток в процессе развития организмов от низших форм к высшим?
4. Определите в сантиметрах общую длину ДНК в клетках человека.
5. ДНК стабильна при рН 11, но РНК деградирует до нуклеотидов при щелочной реакции. Используя учебники по биохимии, объясните причину этого явления.
6. Если субъединицы β и β" РНК-полимеразы составляют 0,005 доли от массы общего белка в клетках Е. coli, то сколько будет в клетке молекул РНК-полимеразы при условии, что каждая субъединица β и β" представляет цельную молекулу этого фермента?
7. Почему мочевина денатурирует РНК?
8. Состав оснований (фракция Г + Ц) двухцепочечной молекулы ДНК отражается на показателях плавучей плотности в хлориде цезия и температуры плавления (Т п), при которой половина молекул «плавится» на отдельные цепи. Было найдено, что плавучая плотность равна 1,660 + (0,098 χ фракция Г + Ц), фракция Г+Ц = 2,44 (Т п - 69,3), причем Т п определена в стандартном солевом растворе. Плавучая плотность ДНК крысы составляет 1,702, D. теlanogaster - 1,698 и дрожжей - 1,699. Определите фракцию Г+Ц и температуру плавления ДНК для каждого вида.
9. Каково значение митохондриальной ДНК человека?
10. Что представляют собой транспозируемые генетические элементы? Как их классифицируют?
11. Что представляют собой плазмиды?
12. Что представляют собой повторяющиеся последовательности ДНК и как часто они повторяются в геноме человека?
13. В чем заключается полуконсервативный способ репликации ДНК и каково биологическое значение такого способа репликации?
14. Какова роль ферментов в репликации ДНК?
15. Есть ли разница между репликацией ДНК и репликацией хромосом?
16. Что такое нуклеосома и каковы ее размеры? Какова роль белков в упаковке ДНК в хромосомы?
17. Вычислите число нуклеотидных пар в 1 мегадальтоне двухцепочечной ДНК.
18. Как вы думаете, сколько генов имеется в одной клетке человека при условии, что длина одного гена составляет около 900 пар нуклеотидов?
19. По данным кислотного гидролиза, препарат ДНК, выделенной из клеток мертворожденного плода человека, характеризовался следующим составом (в %): аденин - 25, тимин - 32, гуанин - 22, цитозин - 21. Каким образом можно объяснить этот необычный результат исследования, руководствуясь данными о структуре ДНК?
20. Какой будут длина и суммарная масса ДНК, если в ней объединить молекулы ДНК из всех клеток новорожденного ребенка, организм которого состоит из 2,5 χ 10 12 клеток?
21. Что представляют собой фрагменты Оказаки и какова их роль в репликации ДНК?
22. Можете ли вы назвать экспериментальные данные, подтверждающие антипараллельную ориентацию цепей в молекуле ДНК?
23. После денатурации ДНК ренатурировали, позволив регибридизацию цепей до 1% их последовательностей. Затем эту ДНК подвергли обработке нуклеазой 1 до полного переваривания молекул, после чего ее «разогнали» путем электрофореза в агарозном геле. Каковы результаты электрофореза?
24. Каким образом можно определить генетическую локализацию /^/-последовательностей в геноме Е. соИ ?
25. В чем заключаются молекулярные механизмы генных мутаций?
26. Опишите механизм действия физических и химических мутагенов.
27. Могут ли восстанавливаться повреждения ДНК и с помощью каких механизмов? Какова роль восстановительных механизмов повреждений ДНК в мутагенезе?
28. Какова разница между индукцией и репрессией ферментов?
29. В чем заключается концепция оперона и каково ее значение в понимании механизмов действия генов?
30. На каких уровнях реализации генетической информации осуществляется генетический контроль экспрессии генов?
31. Чем определяются трудности в изучении генетической регуляции действия генов у эукариот?
32. Сколько типов РНК участвует в биосинтезе белков и что известно о нуклеотидном составе, химических и физических свойствах РНК каждого типа?
33. В научной литературе имеются данные о том, что 7-метилгуанозин- 5-монофосфат ингибирует синтез белков в бесклеточной системе, происходящей из ретикулоцитов. Известно также, что на 5" -конце многих молекул мРНК эукариотических клеток имеется 7-метилгуанозин. Если удалить эту группу из мРНК (химическим путем) вируса везикулярного стоматита, то это не предотвращает трансляцию в бесклеточной ретикулацитной системе. Можете ли вы объяснить значение этих данных?
34. Как вы понимаете механизм генетического импринтинга и каково его биологическое значение?
Генов? Какова её роль? Как работает механизм экспрессии генов? Какие перспективы он перед нами открывает? Как происходит регуляция экспрессии генов у эукариот и прокариот? Вот краткий перечень вопросов, которые будут рассмотрены в рамках данной статьи.
Общая информация
Экспрессия генов - это название процесса переноса от ДНК посредством РНК к белкам и полипептидам. Давайте для понимания сделаем небольшое отступление. Что такое гены? Это линейные полимеры ДНК, что являются соединёнными в длинную цепь. С помощью они образуют хромосомы. Если говорить о человеке, то у нас их сорок шесть. В них находится примерно 50 000-10 000 генов и 3,1 миллиарда пар нуклеотидов. Как же здесь ориентируются? Длина участков, с которыми ведётся работа, указывается в тысячах и миллионах нуклеотидов. Одна хромосома содержит около 2000-5000 генов. В несколько ином выражении - около 130 миллионов пар нуклеотидов. Но это только очень приблизительная оценка, которая более-менее верна для значительных последовательностей. Если работать на коротких участках, то соотношение будет нарушаться. Также на это может повлиять пол организма, над материалом которого ведётся работа.
О генах
Они имеют самую разнообразную длину. Вот, например, глобин - это 1500 нуклеотидов. А дистрофин - уже целых 2 миллиона! Их регуляторные цис-элементы могут быть удалены от гена на значительное расстояние. Так, у глобина они находятся на расстоянии в 50 и 30 тысяч нуклеотидов в 5"- и 3"-направлении соответственно. Наличие подобной организации значительным образом затрудняет нам определение границ между ними. Также гены содержат в себе значительное количество высокоповторяющихся последовательностей, функциональные обязанности которых нам ещё не понятны.
Для понимания их структуры можно представить, что 46 хромосом являются отдельными томами, в которых находится информация. Они сгруппированы в 23 пары. Один из двух элементов наследуется от родителя. "Текст", что находится в "томах", многократно "перечитывался" тысячами поколений, что привносило в него много ошибок и изменений (называемых мутациями). И все они наследуются потомством. Теперь есть достаточно теоретической информации, чтобы начать разбираться с тем, что собой являет экспрессия генов. Это ведь является главной темой данной статьи.
Теория оперона

Она строится на генетических исследованиях индукции β-галактозидазы, которая участвовала в гидролитическом расщеплении лактозы. Сформулирована она была Жаком Моно и Франсуа Жакобом. Данная теория объясняет механизм контроля над синтезом белков у прокариот. Также важная роль отводится и транскрипции. Теория гласит, что гены белков, которые функционально тесно связаны в метаболических процессах, часто группируются вместе. Они создают структурные единицы, названные оперонами. Их важность в том, что все гены, которые входят в него, экспрессируются согласованно. Иными словами, они все могут быть транскрибированы, или же никого из них нельзя «прочитать». В таких случаях оперон считается активным или пассивным. Уровень экспрессии генов может меняться, только если есть набор отдельных элементов.
Индукция синтеза белков
Давайте представим, что у нас есть клетка, которая в качестве источника своего роста использует углерод глюкозу. Если её поменять на дисахарид лактозу, то через несколько минут можно будет зафиксировать, что она адаптировалась к условиям, которые были изменены. Этому существует такое объяснение: клетка может работать обоими источниками роста, но один из них является более подходящим. Поэтому существует «прицел» на более легкообрабатываемое химическое соединение. Но если оно пропадает и на смену ему появляется лактоза, то ответственная РНК-полимераза активируется и начинает оказывать своё влияние на производство необходимого белка. Это больше теория, а сейчас давайте поговорим о том, как же собственно происходит экспрессия генов. Это весьма увлекательно.
Организация хроматина

Материал из данного абзаца представляет собой модель дифференцированной клетки многоклеточного организма. В ядрах хроматин уложен таким образом, что для транскрипции доступна только малая часть генома (около 1 %). Но, несмотря на это, благодаря разнообразию клеток и сложности идущих в них процессов мы можем влиять на них. На данный момент для человека доступным является такое влияние на организацию хроматина:
- Изменять количество структурных генов.
- Эффективно транскрибировать разные участки кода.
- Перестраивать гены в хромосомах.
- Вносить модификации и синтезировать полипептидные цепи.
Но эффективная экспрессия гена-мишени достигается в результате четкого соблюдения технологии. Неважно, с чем ведётся работа, пускай даже эксперимент идёт над небольшим вирусом. Главное - это придерживаться составленного плана вмешательства.
Изменяем количество генов
Как это можно реализовать? Представим, что нас интересует влияние на экспрессию генов. В качестве опытного образца мы взяли материал эукариота. Он обладает высокой пластичностью, поэтому можем внести такие изменения:
- Увеличить число генов. Используется в тех случаях, когда необходимо, чтобы организм увеличил синтез определённого продукта. В подобном амплифицированном состоянии находятся многие полезные элементы человеческого генома (например, рРНК, тРНК, гистоны и так далее). Такие участки могут иметь тандемное расположение в рамках хромосомы и даже выходить за их рамки в количестве от 100 тысяч до 1 миллиона пар нуклеотидов. Давайте рассмотрим практическое применение. Интерес для нас представляет ген металлотионеина. Его белковый продукт может связывать тяжелые металлы вроде цинка, кадмия, ртути и меди и, соответственно, защищать организм от отравления ими. Его активация может быть полезной людям, которые работают в небезопасных условиях. Если у человека наблюдается повышенная концентрация ранее упомянутых тяжелых металлов, то активация гена происходит постепенно автоматически.
- Уменьшить число генов. Это довольно редко применяемый способ регуляции. Но и здесь можно привести примеры. Один из наиболее известных - это эритроциты. Когда они созревают, то разрушается ядро и носитель теряет свой геном. Подобное в процессе созревания проходят и лимфоциты, а также плазматические клетки различных клонов, что синтезируют секретируемые формы иммуноглобулинов.
Перестройка генов

Важной является возможность перемещения и объединения материала, при котором он будет способен к транскрипции и репликации. Данный процесс получил название генетической рекомбинации. С помощью каких механизмов она является возможной? Давайте рассмотрим ответ на этот вопрос на примере антител. Они создаются В-лимфоцитами, что принадлежат какому-то определённому клону. И в случае попадания в тело антигена, на который есть антитело с комплементарным активным центром, произойдёт их присоединение с последующей пролиферацией клетки. Почему же у организма человека есть возможность создавать такое разнообразие белков? Такая возможность обеспечивается рекомбинацией и Но это может быть и следствие искусственных изменений в структуре ДНК.
Изменение РНК
Экспрессия генов - это процесс, в котором значительную роль играет Если рассматривать мРНК, то необходимо заметить, что после транскрипции первичная структура может меняться. Последовательность нуклеотидов в генах одинаковая. А вот в разных тканях мРНК могут появляться замены, вставки или попросту будут происходить выпадения пар. В качестве примера со стороны природы можно привести апопротеин В, создаваемый в клетках тонкого кишечника и печени. В чем же разница редактирования? Версия, создаваемая кишечником, имеет 2152 аминокислоты. Тогда как вариант печени может похвастаться содержанием 4563 остатков! И несмотря на такое различие, у нас имеется именно апопротеин В.
Изменение стабильности мРНК

Мы уже почти пришли к тому, чтобы можно было заняться белками и полипептидами. Но давайте перед этим ещё рассмотрим, как может закрепляться стабильность мРНК. Для этого первоначально она должна покинуть ядро и выйти из цитоплазмы. Осуществляется это благодаря имеющимся порам. Большое количество мРНК будет расщеплено нуклеазами. Те же, что избегут данной участи, организуют комплексы с белками. Время жизни эукариотической мРНК колеблется в широком диапазоне (до нескольких дней). Если стабилизировать мРНК, то при фиксированной скорости можно будет наблюдать, что увеличивается количество новообразованного белкового продукта. Уровень экспрессии генов при этом не изменится, но, что более важно, организм будет действовать с большей эффективностью. С помощью можно кодировать конечный продукт, который будет иметь значительную продолжительность жизни. Так, к примеру, возможным является создание β-глобина, функционирующего примерно десять часов (для него это весьма много).
Скорость процессов

Вот и рассмотрена в общем и целом система экспрессии генов. Сейчас осталось только дополнить имеющиеся знания информацией о том, как быстро происходят процессы, а также насколько долго живут белки. Скажем так, проведём контроль экспрессии генов. Следует отметить, что влияние на скорость не считается основным способом регуляции разнообразия и количества белкового продукта. Хотя её изменение для достижения данной цели всё же использовалось. В качестве примера можно привести синтез белкового продукта в ретикулоцитах. Кроветворные клетки на уровне дифференцировки лишены ядра (а значит, и ДНК). Уровни регуляции экспрессии генов вообще строятся в зависимости от возможностей какого-то соединения активно влиять на осуществляемые процессы.
Длительность существования
Когда же белок синтезирован, то время, в течение которого он будет жить, зависит от протеаз. Здесь нельзя точно назвать сроки, поскольку диапазон в данном случае составляет от нескольких часов до пары лет. Скорость расщепления белка широко варьируется в зависимости от того, в какой клетке он находится. Ферменты, которые могут катализировать процессы, как правило, быстро «употребляются». Из-за этого они также создаются организмом в больших количествах. Также на срок жизни белка может оказать влияние физиологическое состояние организма. Также если был создан дефектный продукт, то он будет быстро ликвидирован защитной системой. Таким образом, можно уверенно сказать, что единственное, о чем мы можем судить, - это стандартное время жизни, полученное в лабораторных условиях.
Заключение

Данное направление является очень перспективным. Например, экспрессия чужеродных генов может помочь вылечить наследственные болезни, а также ликвидировать негативные мутации. Несмотря на наличие обширных знаний по этой теме, можно уверенно сказать, что человечество ещё только находится в самом начале пути. Генетическая инженерия совсем недавно научилась выделять необходимые участки нуклеотидов. 20 лет назад произошло одно из самых больших событий данной науки - была создана овечка Долли. Сейчас же ведутся исследования с человеческими эмбрионами. Можно с уверенностью сказать, что мы уже на пороге будущего, где нет болезней и физиологических страданий. Но прежде чем мы там окажемся, необходимо будет очень хорошо поработать на благо процветания.
Похожие статьи
-
Из архива журнала "Огонёк"
ДМБ-1959! Прием в комсомол. На заседании комитета комсомола 33-й женской школы города Киева принимается в ряды членов КСМУ отличница учебы Светлана Карпова (стоит справа): Тысячная «Победа», 1946 год: «Огонек» август 1941 года Первые три...
-
Самые известные люди в мире
Русская история богата загадочными личностями. Их жизнь порождала слухи, народная молва дополняла образы уникальными чертами. После смерти их имена обрастали новыми мифами и легендами, исключая всякую надежду на возможность...
-
Топовые фразочки. Крылатые фразы. Достойный человек не идет по следам других людей
Look here - Послушайте. What can I do for you? – Чем я могу помочь Вам? Keep in touch. – He пропадай (будь на связи). Good job! – Молодец!It is a good idea. – Это хорошая идея.I don’t саге. – Мне все равно / наплевать.It doesn"t matter. –...
-
Одиночный рейд на место ядерного взрыва Последствия и текущая ситуация
ГЛОБУС - 1. 9 сентября 1971 года жители некоторых деревень Ивановской области неожиданно почувствовали, как земля уходит из-под их ног. Задребезжали стекла в домах, замычали коровы в хлеву. Однако, толком испугаться никто и не...
-
Бойтесь данайцев, дары приносящих: миф о троянском коне
Деревянный конь греков. - Предсказание Кассандры о троянском коне. - Лаокоон ударяет троянского коня копьем. - Синон убеждает ввезти троянского коня в Илион. - Смерть Приама. - Смерть Астианакта, сына Гектора и Андромахи. - Менелай прощает...
-
Иван V Алексеевич, краткая биография и история правления Фамилия ивана v и время его правления
Братья и сестры Петра I весьма многочисленны — только от первой жены, Марии Ильиничны Милославской, у царя Алексея Михайловича родилось 13 детей. Вторая жена, Наталья Кирилловна Нарышкина, кроме Петра родила ещё двух девочек.М. И....
