Гліцин (амінооцтова кислота, глікокол, Gly, G). Хімічні властивості Натрієва сіль амінокислоти
I. За кількістю функціональних груп
Моноаміномоно карбонові кислоти
найпростіший представник:

Моноамінодікарбоновие кислоти

наприклад:

Діаміномонокарбоновие кислоти

наприклад:

II. за взаємному положенню карбоксильної і аміногрупи
-α-амінокислоти

- β-амінокислоти

- γ-амінокислоти

Формули і назви деяких α-амінокислот, залишки яких входять до складу білків

Білки являють собою природні полімери, макромолекули яких побудовані з великого числа залишків 20 різних α-амінокислот. У біохімії для амінокислот використовують, як правило, короткі тривіальні назви і трьохбуквені позначення.
Моноаміномонокарбоновие кислоти
|
Аміноетановая, або амінооцтова кислота, або гліцин (глікокол) |
|
|
2-амінопропановая, або α-амінопропіоновая кислота, або аланін |
|
|
2-аміно-З-гідроксіпропановая, або α-аміно-β-гідроксіпропіоновая кислота, або серин |
|
|
2-аміно-З-меркаптопропановая кислота, або β-меркаптоаланін, або цистеїн |
|
|
2-аміно-З-фенілпропановая кислота, або β-фенілаланін, або фенілаланін |
|
|
2-аміно-3- (4-гідроксифеніл) -пропановая кислота, або β- (n-гідроксіфеніп) -апанін, або тирозин |
|
|
2-аміно-З-метілбутановая, або α-аміноізовалеріановая кислота, або валін |
Моноамінодікарбоновие кислоти
Діаміномонокарбоновая кислота
Класифікація природних амінокислот
I. Замінні амінокислоти - можуть синтезуватися в організмі людини. До них серед перерахованих вище відносяться: гліцин, аланін, серин, цистеїн, тирозин, аспарагінова і глутамінова кислоти.
II. Білки - не можуть синтезуватися в організмі людини, повинні надходити в організм у складі білків їжі. Фенілаланін, валін, лізин - представники незамінних амінокислот.
Фізичні властивості
Більшість амінокислот - безбарвні кристалічні речовини, Добре розчинні у воді. Багато амінокислоти мають солодкий смак. Температури плавлення різних амінокислот лежать в межах 230-300 ° C.
Хімічні властивості
Амінокислоти є амфотерними сполуками, що обумовлено наявністю в їх молекулах функціональних груп кислотного (-СООН) і основного (-NH 2) характеру.
1. Взаємодія з основами

2. Взаємодія з кислотами

3. Освіта внутрішніх солей (біполярних іонів)
У водних розчинах амінокислоти існують у вигляді рівноважних сумішей молекул і біполярних іонів, які в кислому середовищі переходять в катіонну форму, а в лужному середовищі - в аніонну форму.
а) Моноаміномонокарбоновие кислоти

При утворенні внутрішніх солей моноаміномонокарбонових кислот характер середовища не змінюється. Тому ці амінокислоти називаються нейтральними. Сумарний заряд внутрішніх солей таких кислот дорівнює нулю.
При додаванні кислоти (Н +) карбоксилат-іон протоніруется і залишається тільки позитивний заряд на групі -NH
б) Моноамінодікарбоновие кислоти

При утворенні внутрішніх солей моноамінодікарбонових кислот утворюється надлишок іонів водню, тому водні розчини цих кислот мають рН
в) Діаміномонокарбоновие кислоти

При утворенні внутрішніх солей діаміномонокарбонових кислот утворюється надлишок гідроксид-іонів, тому їх водні розчини мають рН\u003e 7. Такі амінокислоти називаються основними. Сумарний заряд внутрішніх солей основних амінокислот позитивний.
4. Освіта пептидів
При взаємодії карбоксильної групи однієї молекули амінокислоти і аміногрупи іншої молекули амінокислоти утворюються дипептиди:

При взаємодії двох різних амінокислот утворюється суміш чотирьох дипептидов; наприклад:

Дипептид, приєднуючи ще одну молекулу амінокислоти, може утворити трипептид. Аналогічно з трипептида можна отримати тетрапептид і т. Д.
5. Освіта похідних по карбоксильної групі
Як і карбонові кислоти, амінокислоти можуть утворювати складні ефіри, хлорангідриди та ін. Наприклад:

6. Поліконденсація ε-амінокапронової кислоти

способи отримання
1. аммоноліз α-галогенкарбонових кислот
2. Гідроліз білків
амінокислоти – це похідні органічних кислот, що містять в радикал одну або кілька аміногруп (NH 2).
За раціональної номенклатурі їх назви мають приставку «аміно» і букви грецького алфавіту (α-, β-, γ- і т.д), що вказують положення аміногрупи по відношенню до карбоксильної групи.
4-амінобутановая
(Γ-аміномасляна)
До складу білків входять α-амінокислоти, яким дають тривіальні назви.
Амінокислоти поділяються на моноамінокарбоновие, діамінокарбоновие, амінодікарбоновие, ароматичні та гетероциклічні: СН 3 -CHNH 2 -СООН аланин (α-амінопропіоновая кислота); H 2 N- (СН 2) 4 -CHNH 2 -СООН лізин (α, ε-діамінокапроновая кислота ); СООН-СН 2 -CHNH 2 -СООН аспарагінова кислота (α-аміноянтарная кислота); З 6 Н 5 СН 2 -CHNH 2 -СООН фенілаланін (α-аміно-β-фенілпропіоновой кислота);

(Піролідин-α-карбонова кислота).
Все α-амінокислотний, часто зустрічаються в живих організмах, мають тривіальні назви, які зазвичай і вживаються в літературі.
Властивості амінокислот.Амінокислоти являють собою кристалічні речовини, як правило, солодкуватого смаку, легко розчинні у воді.
Залежно від кількості амино- або карбоксильних функціональних груп в амінокислоті вона може володіти основними (лізин) або кислотні властивості (аспарагінова кислота).
Аміногрупа і карбоксильная група здатні утворювати біполярний іон або внутрішню сіль:
NH 2-СН 2 -СООН → NH 3 + СН 2 -СОO -.
Наявність -NН 2 і -СООН груп в складі амінокислот обумовлюють їх амфотерні властивості (взаємодіють як з підставами, так і з кислотами).
H 2 N-СН 2 -СООН + NaOH → H 2 N-СН 2 -COONa + Н 2 О
натрієва сіль гліцину
H 2 N-CH 2 -СООН + HCl → Cl -
хлористоводнева сіль гліцину
З спиртами амінокислоти утворюють складні ефіри.
H 2 N-СН 2 -СООН + носно 3  NH 2-СН 2 -СООСН 3 + Н 2 О
NH 2-СН 2 -СООСН 3 + Н 2 О
метиловий ефір гліцину
Характерно освіту внутрішньокомплексних солей міді; реакція може використовуватися при виділенні амінокислот.

мідна сіль гліцину
При нагріванні α-амінокислоти перетворюються в 1,4-дікетопіперазін.

β  -Амінокислоти при нагріванні легко втрачають аміак, утворюючи ненасичені кислоти.
-Амінокислоти при нагріванні легко втрачають аміак, утворюючи ненасичені кислоти.
акрилова кислота
γ, δ, ε-Амінокислоти при нагріванні перетворюються в циклічні аміди - лактами.

ε-амінокапронова кислота капролактам
Основна маса цього продукту використовується для отримання полиамидного волокна - капрону.
Амінокислоти, що містять аміногрупу в α-положенні, піддаються реакції дегідратації з утворенням поліпептидів.
гліцин аланин цистеїн
Назва поліпептиду складається з назв радикалів кислот і повної назви кислоти, в якій зберігається карбоксильная група.
Способи отримання.Отримувати амінокислоти можна при гідролізі білків або з галогенопроізводних кислот при дії аміаку:
α-бромпропіоновая кислота аланін
α-Амінокислоти входять до складу білкової складової їжі і діляться на замінні і незамінні.
Замінні амінокислоти можуть синтезуватися організмом людини або тварини. Білки (метіонін, валін, лейцин, фенілаланін, ізолейцин, триптофан, лізин, треонін) не утворюються в живому організмі і для його нормальної життєдіяльності повинні надходити з їжею. Наприклад, недолік лізину позначається на кровотворної функції і кальцифікації кісток; метіонін володіє противосклеротическим дією; триптофан важливий для процесу зростання, обміну речовин.
Природним джерелом отримання α-амінокислот є білкові речовини (при гідролізі).
Амінокислоти входять до складу рослин, мікроорганізмів, тварин і людини і грають величезну роль в процесах життєдіяльності організмів.
білки – це природні високомолекулярні азотовмісні органічні сполуки, молекули яких побудовані з α-амінокислот, пов'язаних пептидними зв'язками, тобто білки є поліпептидами.
залишок залишок залишок
аланина серина цистеїну
Білки широко поширені в природі, особливо багато їх в організмах тварин і людини. Велика кількість білків міститься в кістках, хрящах, м'язах, в нервових тканинах. З білків складаються волосся, шерсть, пір'я, луска риб, копита, роги і т.п. Білки містяться в яйцях птахів, входять до складу молока, крові та ін. Ферменти, гормони, віруси також мають білкову природу.
Будова білків.Всі білки містять вуглець, водень, кисень, азот (режеS, P, Fe).
Молекулярний вага білків надзвичайно великий - від 5000 до багатьох мільйонів.
Послідовність, з якою з'єднуються залишки α-амінокислот в ланцюзі, називається первинною структуроюбілка. Вона строго унікальна для кожного виду білка.
Поліпептидний ланцюг зазвичай має форму спіралі. Схильність поліпептидного ланцюга до скручування в спіраль зумовлюється первинною структурою білка, але її міцність визначається освітою водневих зв'язків між групами  і -NH- сусідніх витків спіралі.
і -NH- сусідніх витків спіралі.
наприклад:

Особливість скручування поліпептидних ланцюгів білкових молекул в спіраль називається вторинної структуроюбілків.
Витки спіралі можуть так чи інакше складатися або згинатися внаслідок наявності дисульфідних містків -S-S-, що утримують в безпосередній близькості ті чи інші витки, цю роль можуть виконувати і водневі зв'язку. В результаті такого складання ділянок спіралі створюється подоба клубка. Ця форма будови білків називається третинної структурою.
У молекулах деяких білків утворюється по кілька таких «клубків» (глобул), внаслідок чого виникає четвертичная структура.Зв'язки, що з'єднують субодиниці білка в молекулу з четвертинної структурою, - це не ковалентні, а більш слабкі зв'язки, наприклад водневі (як в молекулі гемоглобіну), іонні або так звані гідрофобні взаємодії. Білки, які мають четвертинних структуру, внаслідок слабкості зв'язків, що з'єднують субодиниці, мають здатність оборотно диссоциировать на субодиниці. При цьому може зникати ферментативна активність білків.
Класифікація білків.Білки діляться на дві основні групи: протеїни (прості білки) і протеїди (складні білки). Протеїни складаються тільки з амінокислот і при гідролізі не утворюють інших продуктів. Протеїди складаються з білкової частини, побудованої з α-амінокислот, і з небілкової частини (простетичної групи). При гідролізі ці білки, крім α-амінокислот, постачають та інші речовини: вуглеводи, фосфорну кислоту, гетероциклічні сполуки, барвники тощо
До протеїнів відноситься ряд простих білків, що мають різну розчинність в різних розчинниках.
альбуміни -білки, розчинні у воді, не осідають насиченим розчином хлориду натрію, але осідають насиченим розчином сульфату амонію, згортаються при нагріванні. Представники: альбуміни яйця, молока, сироватки крові, білки ферментів і насіння рослин.
глобуліни -білки, нерозчинні у воді, але розчинні в розбавлених сольових розчинах; згортаються при нагріванні. Мають велику молекулярну масу, ніж альбуміни. Представники: глобуліни молока, яйця, крові, білка м'язів (міозин), насіння рослин.
проламіни -білки, розчинні в 70-80% -ному спирті, нерозчинні в воді і безводному спирті. Чи не згортаються при кип'ятінні. Представники: білки злаків (гліадин - в пшениці, зеин - в кукурудзі).
глютеліни -рослинні білки, нерозчинні в нейтральних сольових розчинах і в етиловому спирті; розчиняються тільки в розведених (0,2%) розчинах лугів. Містяться, головним чином, в насінні злаків. Глютеліни деяких злаків називають глютеніну (від слова клейковина).
гістони -білки основного характеру, так як містять значну кількість діамінокіслот, розчинні у воді і в розбавлених кислотах, але нерозчинні в розведених лугах. Зазвичай представляють білкові частини складних білків. Представники: глобин - білок, що входить до складу гемоглобіну.
протаміни -найбільш прості з природних білків з низькими молекулярними масами; складаються переважно з діамінокіслот і є сильними основами. Добре розчинні у воді, в розбавлених кислотах і лугах. Чи не згортаються при нагріванні. Представники протаминов виявлені в сперматозоїдах риб, в складі складних білків - нуклеопротеїдів.
Альбуміноіди(Склеропротеіни) - білки, що різко відрізняються від інших білків за властивостями. Вони розчиняються лише при тривалій обробці концентрованими кислотами і лугами з розщепленням молекул. У тварин організмах виконують опорні і покривні функції, в рослинах не зустрічаються. Представниками склеропротеінам є: фиброин - білок шовку; кератин - білок волосся, вовни, рогового речовини, епідермісу шкіри; еластин - білок стінок кровоносних судин, сухожиль; колаген - білкова речовина шкіри, кісток, хрящів, сполучних тканин.
протеїди – складні білки, що підрозділяються на підгрупи в залежності від характеру простетической (небелковой) частини.
фосфопротеіди -білки, що містять в якості простетичної групи залишок фосфорної кислоти. Представники: казеїн - білок молока, вителлин - білок, що входить до складу жовтка курячого яйця.
нуклеопротеїди -білки, в яких власне білкова частина пов'язана з нуклеїновими кислотами, А останні при гідролізі утворюють фосфорну кислоту, гетероциклічні сполуки і вуглевод. Нуклеопротеїди входять до складу ядер рослинних і тваринних клітин.
хромопротеїди -речовини, в яких білкова частина з'єднана з барвником. Представник: гемоглобін крові, при гідролізі він розщеплюється, утворюючи білок Глобино і барвник - гем.
глюкопротеіди -білки, у яких білкова частина з'єднана з вуглеводом. Представник: муцин, що входить до складу слини.
ліпопротеїди -з'єднання білків з ліпідами; до останніх відносяться жири, фосфатиди та ін. Ліпопротєїди містяться в протоплазмі клітин, в сироватці крові, в яєчному жовтку.
Білкові речовини класифікують також за формою їх молекул, підрозділяючи на дві групи:
а) фібрилярні (волокнисті) білки, молекули яких мають ниткоподібну форму; до них відносяться фиброин шовку, кератин вовни, міозин м'язів;
б) глобулярні білки, молекули яких мають округлу форму; до них відносяться альбуміни, глобуліни і ряд складних білків.
Харчова цінність білків обумовлена \u200b\u200bякісним і кількісним складом входять до них амінокислот. Розрізняють повноцінні і неповноцінні білки.
Повноцінні білки містять всі незамінні амінокислоти (казеїн молока, яєчний альбумін, білок м'яса).
Неповноцінними називають білки, які не містять хоча б одну з незамінних амінокислот (зеин кукурудзи, желатин).
Властивості білків.Білкові речовини різноманітні за своїм агрегатним станом. Часто це тверді аморфні речовини, що мають вигляд білих порошків. Білки вовни (кератин) і шовку (фиброин) - міцні волокна. Деякі білки отримані в кристалічному стані (гемоглобін крові), багато хто має консистенцію в'язких рідин або холодців.
Всі білки не розчиняються в безводному спирті та інших органічних розчинниках. Багато білки розчиняються у воді і в розбавлених розчинах солей, але утворюють не істинні, а колоїдні розчини. Існують білки, абсолютно нерозчинні у воді.
Розчини природних білків оптично активні (в основному володіють лівим обертанням).
Білки, подібно амінокислотам, амфотерни і утворюють солі як з кислотами, так і з підставами:
H 3 N + -R-COO - + H + + Cl -  NH 3 + -R-COOH + Сl -;
NH 3 + -R-COOH + Сl -;
H 3 N + -R-COO - + Na + + OH -  NH 2 -R-COO - + Na + + H 2 O.
NH 2 -R-COO - + Na + + H 2 O.
У присутності кислот білкові молекули несуть позитивний заряд і при електролізі пересуваються до катода, в присутності лугів білкові молекули несуть негативний заряд і пересуваються до анода. При певному значенні рН в розчині буде міститися мінімальна кількість катіонів та аніонів білка; в цих умовах пересування молекул білка при електрофорезі не відбувається. Значення рН розчину, при якому в розчині білка міститься мінімальна кількість катіонів та аніонів, називається ізоелектричної точкою.Для різних білків значення ізоелектричної точки неоднаково. Наприклад, для яєчного білка (альбуміну) ізоелектричної точка знаходиться при рН \u003d 4,8, для білка пшениці (гліадин) - при рН \u003d 9,8.
Для всіх білків характерні деякі загальні властивості: реакції осадження з розчинів і кольорові реакції.
Осадження білків з розчинів.При додаванні до водних розчинів білків концентрованих розчинів мінеральних солей (наприклад, (NH 4) 2 SO 4) білки осідають, аналогічно діє на білок спирт, ацетон. У всіх цих випадках білки не змінюють своїх властивостей і при розведенні водою знову переходять в розчин. Цей процес називається висолюванням.
При нагріванні багато білків згортаються (наприклад, яєчний білок) і теж осідають з розчинів, але втрачають здатність розчинятися у воді. При цьому відбувається значна зміна властивостей білків. Цей процес незворотного осадження білків називається денатурацією.Денатурацію можуть викликати солі важких металів (CuSO 4, Pb (CH 3 COO) 2, HgClі ін.), Концентровані кислоти (HNO 3, H 2 SO 4, CH 3 COOH, пікринова, хлоруксусная), їдкі луги (КОН, NaOH) , фенол, формалін, танін та ін.
Денатурацію білка викликають також різні види випромінювань (ультрафіолетове, радіоактивне та т.п.). При денатурації руйнується четвертичная, третинна, вторинна структури; первинна структура при цьому зазвичай зберігається, тобто руйнування пептидних зв'язків не відбувається. Первинна структура білка руйнується при гідролізі білка, що і відбувається в процесі засвоєння білкової їжі. У шлунково-кишковому тракті під дією ферментів білки їжі розщеплюються через ряд проміжних продуктів до амінокислот. З комбінації отриманих амінокислот в організмі створюються необхідні йому білки. Невикористані залишки білків піддаються руйнуванню до більш простих з'єднань і виводяться з організму.
Кольорові реакції білків.
1. Біуретова реакція.
При взаємодії з солями міді (CuSO 4) в лужному середовищі все білки дають фіолетове забарвлення. Ця реакція є якісною на пептидні зв'язки і підтверджує наявність їх в білках і поліпептидах. Для різних поліпептидів забарвлення, що виникає при взаємодії з солями міді, неоднакова: дипептиди дають синє забарвлення, трипептиди-фіолетову, а більш складні поліпептиди-червону.
2. Ксантопротеиновая реакція.
При нагріванні розчинів білків з концентрованою азотною кислотою (HNO 3) вони забарвлюються в жовтий колір. Реакція пояснюється наявністю в білках амінокислот, що містять ароматичні вуглеводні радикали (С 6 Н 5 -), які при взаємодії з азотною кислотою утворюють нитросоединения, пофарбовані в жовтий колір.
3. цистинових реакція (сульфгідріл'ная).
Якщо прокип'ятити розчин білка з надлишком їдкого натру і додати кілька крапель розчину ацетату свинцю Рb (СН 3 СОО) 2, то з'являється буро-чорне забарвлення або осад.
Білок + NaOH  Na 2 S + ін. Речовини.
Na 2 S + ін. Речовини.
Na 2 S + Pb (CH 3 COO) 2 → PbS ↓ + 2CH 3 COONa.
Реакція підтверджує наявність слабо пов'язаної сірки в білках.
Є і ряд інших якісних реакцій на білок.
Значення і застосування білків.Білки є найважливішою складовою частиною харчових продуктів. Більше 50% білків в раціоні харчування людини повинні становити білки тваринного походження. Дорослій людині на добу потрібно 80-100 г білка, а при великому фізичному навантаженні - 120 г і більше.
Білкові речовини знаходять широке застосування у виробництві промислових товарів (вироби зі шкіри, вовни, хутра, шовку), у виробництві клею, желатину, пластмас (галалита), штучної шерсті, для приготування світлочутливих емульсій в фотопромисловості і ін.
Багато лікарські препарати мають білкову природу (інсулін, панкреотін і ін.). Особливо слід виділити біологічні каталізатори - ферменти, що також є білковими речовинами. Часто вони присутні лише в незначних кількостях, вони сприяють швидким хімічним перетворенням величезних кількостей різних речовин в дуже м'яких умовах (низька температура і т.д.).
Віруси, бактерії також мають білкову природу. Тому при консервуванні харчових продуктів, лікуванні різних захворювань використовують препарати, які денатурують білкові речовини (саліцилова кислота, аспірин, салол, танін, різні поліфеноли, оцтова кислота та ін.).
Білки є речовинами, абсолютно необхідними для життя тварин, рослин, мікроорганізмів. Саме життя є процесом складних перетворень білкових речовин.
Гліцин (амінооцтова кислота, глікокол, Gly, G)
H 2 NCH 2 COOH
Молекулярна маса 75,07; безбарвні кристали; t плавлення 232-236 ° С (з розкладанням); добре розчинний у воді, не розчинний в більшості органічних растворітеей. При 25 ° С р До а 2,34 (СООН) і 9,6 (NH 2); р I 5,97.
За хімічними властивостями гліцин - типова аліфатична α-амінокислота. Кількісне визначення засноване на освіту забарвлених продуктів з про-фталевим альдегідів (реакція Циммермана). У складі білків зустрічається частіше, ніж ін. Амінокислоти. Служить попередником в біосинтезі порфіринових з'єднань і пуринових підстав. Гліцин - кодується амінокислота, замінна; його біосинтез здійснюється переамінуванням гліоксилової кислоти, ферментативним розщепленням серина і треоніну. Синтезують Ліцинієм з хлоруксусной кислоти і NH 3. У спектрі ЯМР в D 2 Про хімічний зсув протонів групи СН 2 становить 3,55 м.д. Внутрішня сіль гліцину (CH 3) 3 + NCH 2 COO - називається бетаїном.
Застосовується гліцин для синтезу пептидів, як компонент буферних растворовров, в суміші з іншими амінокислотами - для парентерального харчування.
Хроматограми зразків, що містять цю речовину
Амінокислоти - це органічні амфотерні сполуки. Вони містять у складі молекули дві функціональні групи протилежного характеру: аміногрупу з основними властивостями і карбоксильну групу з кислотними властивостями. Амінокислоти реагують як з кислотами, так і з підставами:
Н 2 N-СН 2 -СООН + HCl → Сl [Н 3 N-СН 2 -СООН],
Н 2 N-СН 2 -СООН + NaOH → H 2 N-CH 2 -COONa + Н 2 О.
При розчиненні амінокислот у воді карбоксильная група отщепляет іон водню, який може приєднатися до аміногрупи. При цьому утворюється внутрішня сіль, молекула якої представляє собою біполярний іон:
H 2 N-CH 2 -СООН + Н 3 N-СН 2 -СОO -.
Кислотно-основні перетворення амінокислот в різних середовищах можна зобразити наступною загальною схемою:

Водні розчини амінокислот мають нейтральну, лужну або кисле середовище в залежності від кількості функціональних груп. Так, глутамінова кислота утворює кислий розчин (дві групи -СООН, одна -NH 2), лізин - лужний (одна група -СООН, дві -NH 2).
Подібно первинним амінів, амінокислоти реагують з азотистої кислотою, при цьому аминогруппа перетворюється в гидроксогрупп, а амінокислота - в гідроксикислоти:
H 2 N-CH (R) -COOH + HNO 2 → HO-CH (R) -COOH + N 2 + H 2 O
Вимірювання обсягу виділився азоту дозволяє визначити кількість амінокислоти ( метод Ван-Слайка).
Амінокислоти можуть реагувати зі спиртами в присутності газоподібного хлороводню, перетворюючись в складний ефір (Точніше, в хлороводневу сіль ефіру):
H 2 N-CH (R) -COOH + R'OH H 2 N-CH (R) -COOR '+ Н 2 О.
Складні ефіри амінокислот не мають біполярної структури і є летючими сполуками.
Найважливіша властивість амінокислот - їх здатність до конденсації з утворенням пептидів.
якісні реакції.
1) Усі амінокислоти окислюються нингидрином

з утворенням продуктів, забарвлених в синьо-фіолетовий колір. Імінокіслота пролин дає з нингидрином жовте забарвлення. Ця реакція може бути використана для кількісного визначення амінокислот спектрофотометричним методом.
2) При нагріванні ароматичних амінокислот з концентрованою азотною кислотою відбувається нітрування бензольного кільця і \u200b\u200bутворюються сполуки, забарвлені в жовтий колір. Ця реакція називається ксантопротеиновой (Від грец. Ксантос - жовтий).
Білки - це поліпептиди досить великий молекулярної маси, мають певну просторову структуру, яка залежить від послідовності входять в білкову ланцюг амінокислот. Ця структура може бути компактною (глобулярні білки) або витягнутої (фібрилярні білки). Всі ферменти - глобулярні білки, до фібрилярні ж належать колаген, кератин - білки шкіри, волосся, дуже міцні і добре розтяжні.
За складом білки ділять на прості, що складаються тільки з амінокислот, і складні - комплекси або ковалентні сполуки поліпептидів з молекулами інших класів:
нуклеїновими кислотами - нуклеопротеїни;
полісахариди - глікопротеїни;
ліпідами - ліпопротеїди;
пігментами - хромопротеїди;
залишками фосфорної кислоти - фосфопротеіди.
Білкову частину складного білка називають апобілки, Небілкову - простетичної групою. Майже всі прості і складні глобулярні білки є ферментами - біологічними каталізаторами біохімічних реакцій в живих організмах.
завдання
Завдання 1.Який обсяг газу (в нормальних умовах) виділиться при реакції з азотистої кислотою 0,001 благаючи амінокислоти: а) лейцину; б) лізину; в) пролина?
Рішення
Запишемо рівняння реакцій перерахованих амінокислот з азотистої кислотою. У разі лейцину і лізину відбувається дезамінування по Ван-Слайка, причому у лізину - по двом аминогруппам, що містяться в молекулі. У проліном немає первинної аміногрупи, тому процес зупиняється на стадії N-нітрозірованія.
В реакції (а) кількість молей лейцину n (Лей) дорівнює кількості молей виделевшегося азоту n (N 2), тому виділяється 0,001 благаючи, або 22,4 мл азоту. В реакції (б) утворюється подвійну кількість газу 2n (N 2) в порівнянні з n (ліз), так як у вихідній амінокислоті дві первинні аміногрупи; обсяг виділився азоту складе 44,8 мл. В реакції (в) азот не виділяється: пролін - єдина з 20 найважливіших амінокислот, у якій в a-положенні знаходиться вторинний атом азоту. При його нітрозірованія утворюється N-нітрозо- (а не діазо-) з'єднання.
відповідь:а) 22,4 мл N 2; б) 44,8 мл N 2; в) немає виділення N 2.
Завдання 2.В результаті обробки розчину, що містить 9,36 мг невідомої амінокислоти, надлишком азотної кислоти при 748 мм рт.ст. і 20 ° С отримано 2,01 мл азоту. Яка мінімальна молярна маса цієї амінокислоти?
Рішення
Реакція амінокислоти з азотистої кислотою:

використовуючи об'єднаний газовий закон PV / T \u003d const, Розрахуємо обсяг азоту при нормальних умовах (при температурі 0 ° С, або 273 ° К, і тиску 760 мм рт.ст.): V 0 (N 2) (н.у.) \u003d (Р 1 · V 1 · T 0) / (P 0 · T 1) \u003d (748 · 2,01 · 273) / (760 · 293) \u003d 1,84 мл.
Оскільки кількості молей речовини амінокислоти і газу, що виділяється N2 однакові, складемо пропорцію:
9,36 мг амінокислоти дає 1,84 мл N 2;
M (молекулярна маса амінокислоти) дасть \u003d 22,4 N 2.
М \u003d (9,36 · 22,4) / 1,84 \u003d 114.
Це може бути валін: 
Завдання 3.Гемоглобін тваринного містить 0,335% заліза (по масі). Яка мінімальна молярна маса цього білка? Скільки атомів заліза входить до складу молекули, якщо певна методом вимірювання осмотичного тиску молекулярна маса білка дорівнює 67000?
Рішення
Масова частка заліза в гемоглобіні: З% (Fe) \u003d / M (білка), де n - число атомів Fe в молекулі білка. Нехай n \u003d 1, тоді М (білка) 1 \u003d M (Fe) · 100% / C% (Fe) \u003d 56 · 100 / 0,335 \u003d 16700. Оскільки істинне значення (за умовою) М (білка) іст. \u003d 67000, n \u003d М іст. / М 1 \u003d 67000/16700 \u003d 4.
Завдання 4.При лужному гідролізі 48 г дипептида, що складається із залишків однієї і тієї ж амінокислоти, утворилося тільки одна речовина - натрієва сіль амінокислоти. Маса цієї солі дорівнює 66,6 м Встановіть будову дипептида.
Рішення
Рівняння реакції лужного гідролізу дипептиду:
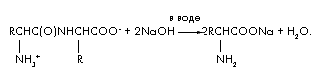
Позначимо кількість дипептида в молях (дипептида) \u003d х. Тоді в реакції гідролізу витрачається подвійну кількість лугу (NaOH) \u003d 2х і утворюється (амінокислоти) \u003d 2х і (H2O) \u003d х. складемо рівняння матеріального балансу, Використовуючи формулу m \u003d · M;
m (дипептида) + m (NaOH) \u003d m (солі амінокислоти) + m (H 2 O); 48 + 2х · 40 \u003d 66,6 + х · 18; 62х \u003d 18,6; х \u003d 0,3 благаючи. M (дипептида) \u003d m / \u003d 48 / 0,3 \u003d 160. M (амінокислоти) \u003d [М (дипептида) + M (H 2 O)] / 2 \u003d 178/2 \u003d 89 г / моль. Амінокислота - аланін. Будова дипептида: ![]() .
.
Схожі статті
-
В якій послідовності краще читати Террі Пратчетта, з чого почати?
«Це б-ла нас-то-ящая га-Зета з 96 стра-ка-ми част-них об'єк-яв-ле-ний. Імен-но там я ви-вчив-ся азам мас-терс-тва, трю-кам, саль-ним шу-точ-кам, сом-ні-тель-но-му біт-кло-ру і штам-пам ре- ги-Онал-ної жур-на-лис-ти-ки. І це б-ло ...
-
Планета Меркурій - найближча до Сонця Атмосфера меркурій на 99 складається з
Зараз набула широкого розповсюдження-страненіе ідея про те, що Меркурій був колись супутником Венери. Ця гіпотеза народилася в кінці XIX в. До гіпотезі не сто-сілісь серйозно до тих пір, поки перші польоти космічних апаратів до Меркурія ні ...
-
Кіберкуб - перший крок в четвертий вимір 4 х мірний куб gif
В геометрії гиперкуб - це n-мірному аналогія квадрата (n \u003d 2) і куба (n \u003d 3). Це замкнута опукла фігура, що складається з груп паралельних ліній, розташованих на протилежних краях фігури, і з'єднаних один з одним під прямим ...
-
Хто такі масони? Масони: хто вони? Що значить Массон
Уже в новий час масони створили тексти, де доводили давнє походження свого ордена. Якщо поцікавитися, хто такі масони і чим вони займаються, можна помітити, що вони серйозно відрізняються від своїх попередників. Перші ...
-
Найважливіші правила поведінки для учнів в школі Правило поведінки як вести в школі
Сучасний етикет - це цілий комплекс правил поведінки і хороших манер, який вчить, як треба знайомитися, вітатися, як вести себе в громадських місцях, як ходити в гості, як правильно накривати на стіл і вести себе під час ...
-
Українська історія і російська весна Російська весна вікі
Є серйозні підозри, що сайт «Російська весна» rusvesna.su є американським провокаційним проектом.Сам сайт якісний. Добірка новин теж хороша, але є серйозні насторожуючі моменти.1. Абсолютно незрозуміло хто стоїть за ...







