Рівняння реакції бензолу. Хімічні властивості бензолу. Будова молекули бензолу
Таким з'єднанням, як бензол, пані Хімія в своєму господарстві остаточно і безповоротно обзавелася тільки в 1833 році. Бензол - це з'єднання, яке має запальний, можна сказати, навіть вибуховий характер. Як це з'ясували?
Історія
Іоган Глаубер в 1649 році звернув свою увагу на з'єднання, яке благополучно утворилося, коли хімік займався обробкою кам'яновугільної смоли. Але воно побажало залишитися інкогніто.
Через близько 170 років, а якщо бути набагато більш точним, в середині двадцятих років XIX століття, з волі випадку з светильного газу, а саме з виділився конденсату, витягли бензол. Таким старанням людство зобов'язане Майклу Фарадею, вченому з Англії.
Естафету з придбання бензолу перехопив німець Ейльгард Мічерліх. Це сталося, коли проходив процес обробки безводних солей кальцію бензойної кислоти. Можливо, тому з'єднанню дали таке найменування - бензол. Ще, як варіант, вчений називав його бензином. Пахощі, якщо в перекладі з арабського.
Бензол красиво і яскраво горить, в зв'язку з цими спостереженнями Огюст Лоран порадив назвати його «фен» або «бензен». Яскравий, блискучий - якщо перекласти з грецької мови.
Спираючись на думку поняття про природу електронного зв'язку, про якостях бензолу, вчений надав молекулу з'єднання у вигляді наступного способу. Це шестикутник. У нього вписане коло. Вищесказане говорить про те, що у бензолу цілісне електронну хмару, яке благополучно укладає шість (без винятку) атомів вуглецю циклу. Скріплених бінарних зв'язків не спостерігається.
З бензолом раніше працювали як з розчинником. А в основному, як то кажуть, не перебував, не брав участі, не залучався. Але це в XIX столітті. У XX відбулися істотні зміни. Властивості бензолу висловлюють найцінніші якості, які допомогли йому стати більш популярним. Октанове число, яке виявилося високим, надало можливість застосовувати його в якості елемента палива для заправки автомобілів. Це дійство послужило поштовхом великого вилучення бензолу, видобуток оного здійснюється як вторинний продукт коксування виготовлення сталі.
До сорокових років в хімічній сфері бензол почав споживатися у виготовленні речовин, які швидко вибухають. XX століття увінчав себе тим, що нафтопереробна промисловість виробила бензолу стільки, що стала постачати хімічну індустрію.
характеристика бензолу
Ненасичені вуглеводні дуже схожі з бензолом. Наприклад, вуглеводневий ряд етилену характеризує себе як ненасичений вуглеводень. Йому властива реакція приєднання. Бензол охоче вступає в Все це завдяки атомам, які знаходяться в одній площині. І як факт - поєднане електронну хмару.

Якщо у формулі присутній бензольне кільце, значить, можна прийти до елементарного висновку, що це - бензол, структурна формула якого виглядає саме так.
Фізичні властивості
Бензол - це рідина яка не має кольору, зате має гідний жалю запах. Плавиться бензол, коли температура досягає 5,52 градусів за Цельсієм. Кипить при 80,1. Щільність становить 0,879 г / см 3, маса молярна дорівнює 78,11 г / моль. При горінні сильно коптить. Формує вибухонебезпечні сполуки, коли проникає повітря. породи (бензин, ефір та інші) з описуваних речовиною з'єднуються без проблем. Азеотропна з'єднання створює з водою. Нагрівання до початку паротворення відбувається при 69,25 градусів (91% бензолу). При 25 градусах за Цельсієм може розчинятися у воді 1,79 г / л.
Хімічні властивості
Бензол реагує із сірчаною і азотною кислотою. А також з алкенами, галогенами, хлоралканамі. Реакція заміщення - ось що йому властиво. Температура тиску впливає на прорив кільця бензолу, яке проходить в досить різких умовах.
Кожне рівняння реакції бензолу ми можемо розглянути більш детально.
1. Електрофільне заміщення. Бром, при наявності каталізатора, взаємодіє з хлором. В результаті отримуємо хлоробензол:
С6H6 + 3Cl2 → C6H5Cl + HCl
2. Реакція Фріделя-Крафтса, або алкілування бензолу. Поява алкилбензолов відбувається завдяки з'єднанню з алканами, які є галогенопроїзводниє:
C6H6 + C2H5Br → C6H5C2H5 + HBr
3. Електрофільне заміщення. Тут йде реакція нітрування і сульфирования. Виглядати рівняння бензолу буде наступним чином:
C6H6 + H2SO4 → C6H5SO3H + H2O
C6H6 + HNO3 → C6H5NO2 + H2O
4. Бензол при горінні:
2C6H6 + 15O2 → 12CO2 + 6H2O
При певних умовах проявляє характер, властивий насиченим вуглеводнів. П-електронну хмару, яке знаходиться в будові даної речовини, пояснює ці реакції.
Від спецтехнології залежать різні види бензолу. Звідси походить маркування нафтового бензолу. Наприклад, очищений і вищої очистки, для синтезу. Хотілося б окремо відзначити гомологи бензолу, а якщо конкретніше - їх хімічні властивості. Це алкілбензоли.

Гомологи бензолу набагато охочіше реагують. Але вищезазначені реакції бензолу, а саме гомологів, проходять з деяким відзнакою.
Галогенування алкилбензолов
Вид рівняння наступний:
С6H5-CH3 + Br \u003d C6H5-CH2Br + HBr.
Прагнення брому в кільце бензолу не спостерігається. Він виходить в ланцюжок збоку. Зате завдяки каталізатору солі Al (+3) бром сміливо йде в кільце.
нітрування алкилбензолов
Завдяки сірчаної та азотної кислот нітріруются бензоли і алкілбензоли. Реакційноздатні алкілбензоли. Виходять два продукти з представлених трьох - це пара- і орто-ізомери. Можна записати одну з формул:
C6H5 - CH3 + 3HNO3 → C6H2CH3 (NO2) 3.
окислення
Для бензолу це неприйнятно. Зате алкілбензоли реагують охоче. Наприклад, бензойна кислота. Формула наведена нижче:
C6H5CH3 + [O] → C6H5COOH.
Алкілбензол і бензол, їх гідрування
У присутності підсилювача водень починає реагувати з бензолом, внаслідок чого утворюється циклогексан, як про це говорилося вище. Подібним чином алкібензоли без проблем перетворюються в алкілціклогексани. Для отримання алкілціклогексана потрібно піддати гидрированию потрібний алкілбензол. В основному це необхідна процедура для виробництва бездомішкового продукту. І це далеко не все реакції бензолу і Алкілбензоли.
Виробництво бензолу. промисловість
Фундамент такого виробництва грунтується на тому, щоб переробити складові: толуолу, Нафти, смоли, яка виділяється при крекінгу вугілля, та інших. Тому бензол виробляється на нафтохімічних, металургійних підприємствах. Важливо знати, як отримати бензол різного ступеня очищення, адже від принципу виготовлення і призначення слід пряма залежність марки даної речовини.
Левову частку виготовляють термокаталітіческім риформінгу каустобіолітной частини, википає при 65 градусах, що володіє ефектом екстракту, дистиляції з диметилформамидом.
При виробленні етилену і пропилену отримують рідкі продукти, які утворюються в ході розпаду неорганічних і органічних сполук під впливом тепла. З них і виділяють бензол. Але, на жаль, вихідного матеріалу для цього варіанту видобутку бензолу не так вже й багато. Тому цікавить нас речовина добувають риформингом. За допомогою такого способу обсяг бензолу збільшується.

Шляхом деалкилирования при температурі 610-830 градусів зі знаком плюс, при наявності пари, що утворюється при кипінні води і водню, з толуолу отримують бензол. Є ще варіант - каталітичний. Коли спостерігається наявність цеолітів, або, як варіант, каталізаторів оксидних, при дотриманні температурного режиму 227-627 градусів.
Існує ще один, більш старий, спосіб розробки бензолу. За допомогою абсорбції поглиначами органічного походження його виділяють з кінцевого результату коксування кам'яного вугілля. Продукт парогазовий і заздалегідь піддався охолодження. Наприклад, в хід пускається масло, джерелом якого є нафта або кам'яне вугілля. Коли перегонка здійснюється з водяною парою, поглинач відділяється. Гидроочистка допомагає сирої бензол звільнити від зайвих речовин.
кам'яновугільний сировину
У металургії при використанні кам'яного вугілля, а якщо уточнити - його сухий перегонки, отримують кокс. Під час цієї процедури обмежується надходження повітря. Не варто забувати і те, що до температури 1200-1500 за Цельсієм нагрівається вугілля.
Вуглехімічний бензол потребує доскональному очищенні. Потрібно позбутися в обов'язковому порядку від метилу циклогексана і його товариша н-гептану. теж повинні бути вилучені. Бензолу належить процес поділу, очищення, який буде здійснюватися не один раз.
Метод, описаний вище, найстаріший, але після закінчення часу він втрачає свої високі позиції.
нафтові фракції
0,3-1,2% - такі показники складу нашого героя в необробленої нафти. Мізерні показники, щоб вкладати фінанси і сили. Найкраще задіяти промислову процедуру по переробці нафтових фракцій. Тобто каталітичний риформінг. При наявності алюмо-платино-ренієві підсилювача зростає відсоток вміщення ароматичних вуглеводів, і зростає показник, що визначає можливості палива не самозайматися при його стисненні.
смоли піролізу
Якщо добувати наш нафтопродукт з непостійна сировини, а саме шляхом піролізу виникають при виготовленні пропілену і етилену, то цей підхід виявиться найбільш прийнятним. Якщо бути точним, бензол виділяється з піроконденсата. Розкладання певних часткою потребує гідроочистки. При очищенні усуваються сірчисті і ненасичені суміші. У вихідному результаті помічено зміст ксилолу, толуолу, бензолу. За допомогою перегону, який є екстактівним, БТК-група розділяється і виходить бензол.

Гідродеалкілірованіе толуолу
Головні герої процесу, коктейль з водневого потоку і толуолу, подаються нагрітими в реактор. Толуол проходить через пласт каталізатора. Під час цього процесу метильная група відокремлюється з формуванням бензолу. Тут доречний певний спосіб очищення. Результатом стає Високочисте речовина (для нітрування).
диспропорционирование толуолу
У слідстві відторгнення метильного класу відбувається творення до бензолу, окислюється ксилол. В даному процесі було помічено переалкілірованіе. Дія каталізації відбувається завдяки паладію, платини і неодиму, які знаходяться на оксиді алюмінію.
У реактор зі стійким шаром каталізатора подається талуол і водень. Його мета - утримати осідання на площину каталізатора вуглеводнів. Потік, який виходить з реактора, піддається охолодженню, а на рецикл благополучно витягається водень. Те, що залишилося, переганяється тричі. На початковій стадії вилучаються сполуки, які є неароматичного. Другим видобувається бензол, і останній крок - це виділення ксилолов.
ацетилену тримеризация
Завдяки працям французького фізико-хіміка Марсель Бертло з ацетилену стали виготовляти бензол. Але при цьому виділявся важкий коктейль з багатьох інших елементів. Стояло питання, як знизити температуру реакції. Відповідь була отримана лише в кінці сорокових років XX століття. В. Реппе знайшов відповідний каталізатор, ним виявився нікель. Тримеризация - це єдиний варіант отримати з ацетилену бензол.

Освіта бензолу відбувається за допомогою активованого вугілля. При високих показниках теплоти над вугіллям проходить ацетилен. Бензол виділяється, якщо температура становить не менше 410 градусів. При цьому ще народжуються різноманітні ароматичні вуглеводні. Тому необхідна хороша апаратура, яка здатна якісно очистити ацетилен. При такому трудомісткий спосіб, як тримеризация, ацетилену витрачається дуже багато. Щоб отримати 15 мл бензолу, береться 20 літрів ацетилену. Ви можете переглянути, як це виглядає в реакція не змусить себе довго чекати.
3C2H2 → C6H6 (рівняння Зелінського).
3CH → CH \u003d (t, kat) \u003d C6H6.
Де використовується бензол
Бензол - це досить популярне дітище хімії. Особливо часто було помічено, як бензол брали на озброєння в виготовленні кумола, циклогексана, етилбензолу. Для створення стиролу без етилбензолу не обійтися. вихідним матеріалом для того, щоб виробити капролактам, служить циклогексан. Виготовляючи термопластичну смолу, застосовують саме капролактам. Описується речовина незамінне при виготовленні різних фарб, лаків.
Наскільки небезпечний бензол
Бензол - це токсична речовина. Прояв відчуття нездужання, яке супроводжується нудотою і сильним запамороченням - це ознака отруєння. Не виключається навіть летальний результат. Почуття невимовного захвату - це не менш тривожні дзвіночки при отруєнні бензолом.
бензол в рідкому стані викликає роздратування шкіри. Бензольні пари з легкістю проникають навіть через неушкоджений шкірний покрив. При самих недовгострокового контактах з речовиною в невеликій дозі, але на регулярній основі, неприємні наслідки не змусять себе довго чекати. Це може бути ураження кісткового мозку і лейкози гострого характеру різного виду.

До всього іншого, речовина викликає залежність у людини. Бензол діє як дурман. З тютюнового диму виходить баріться продукт. Коду його вивчили, то прийшли до висновку, що зміст останнього небезпечно для людини. Виявилося крім присутності нікотину ще і наявність ароматичних вуглеводів виду бензопірену. відмінною рисою бензпирена є канцерогенні речовини. Дія вони надають дуже шкідливий. Наприклад, викликають онкологічні захворювання.
Незважаючи на вищесказане, бензол є стартовим сировиною для виробництва різноманітних лікарських препаратів, Пластмас, гуми синтетичного походження і, звичайно ж, барвників. Це найпоширеніше дітище хімії і ароматичне з'єднання.
Циклічну структуру бензолу вперше запропонував Ф.А. Кекуле в 1865 р

Фрідріх Август Кекуле фон Страдониц - видатний німецький хімік XIX в. У 1854 р він виявлені перші органічна сполука, Що містить сірку - тіоуксусную кислоту (тіоетановую кислоту). Крім того, він встановив структуру диазосоединений. Олнако його найбільш відомим внеском в розвиток хімії є встановлення структури бензолу (1866). Кекуле показав, що подвійні зв'язки бензолу чергуються по кільцю (ця ідея вперше виникла у нього уві сні). Пізніше він показав, що два можливих розташування подвійних зв'язків ідентичні і що бензольне кільце являє собою гібрид між цими двома структурами. Таким чином, він передбачив уявлення про резонанс (Мезомерія), яке з'явилося в теорії хімічного зв'язку на початку 1930-х рр.
Якби бензол дійсно мав таку структуру, то його 1,2-дизаміщених похідні повинні були мати по два ізомери. наприклад,

Однак ні у одного з 1,2-дизаміщених бензолів не вдається виділити два ізомери.
Тому згодом Кекуле припустив, що молекула бензолу існує як дві швидко переходять один в одного структури:

Зауважимо, що в таких схематичних зображеннях молекул бензолу і його похідних зазвичай не вказуються атоми водню, приєднані до вуглецевим атомам бензольного кільця.
У сучасній хімії молекулу бензолу розглядають як резонансний гібрид з цих двох граничних резонансних форм (див. Розд. 2.1). Друге окреслення молекули бензолу засновано на розгляді її молекулярних орбіталей. У розд. 3.1 було зазначено, що -Електронна, що знаходяться на -зв'язуючим орбиталях, делокалізованних між усіма атомами вуглецю бензольного кільця і \u200b\u200bутворюють -Електронна хмара. Відповідно до такого поданням молекулу бензолу можна умовно зобразити таким чином:
Експериментальні дані підтверджують наявність у бензолу саме такої структури. Якби бензол мав структуру, яку припустив спочатку Кекуле, з трьома зв'язаними подвійними зв'язками, то бензол повинен був вступати в реакції приєднання подібно алкенам. Однак, як було вже зазначено вище, бензол не вступає в реакції приєднання. Крім того, бензол володіє більшою стійкістю, ніж якби він мав три ізольовані подвійні зв'язку. У розд. 5.3 було зазначено, що ентальпія гідрування бензолу з утворенням циклогексану має більше негативний
Таблиця 18.3. Довжина різних вуглець-вуглецевих зв'язків


Мал. 18.6. Геометричну будову молекули бензолу.
значення, ніж потроєна ентальпія гідрування циклогексен. Різниця цих величин прийнято називати ентальпії делокализации, резонансної енергією або енергією стабілізації бензолу.
Все вуглець-вуглецеві зв'язки в бензольному кільці мають однакову довжину, Яка менше, ніж довжина зв'язків С-С в алканах, але більше, ніж довжина зв'язків С \u003d С в алкенів (табл. 18.3). Це служить підтвердженням того, що вуглець-вуглецеві зв'язки в бензолі представляють собою гібрид між простими і подвійними зв'язками.
Молекула бензолу має плоску структуру, яка зображена на рис. 18.6.
Фізичні властивості
Бензол при нормальних умовах - безбарвна рідина, яка замерзає при 5,5 ° С і кипить при 80 ° С. Він має характерний приємний запах, але, як зазначалося вище, сильно токсичний. Бензол не змішується з водою і в системі бензол вода утворює верхній з двох шарів. Однак він розчиняється в неполярних органічних розчинниках і сам є хорошим розчинником інших органічних сполук.
Хімічні властивості
Хоча бензол вступає в певні реакції приєднання (див. Нижче), він не проявляє в них типовою для алкенів реакційної здатності. Наприклад, він не знебарвлює бромную воду або розчин іонів. Крім того, бензол НЕ
вступає в реакції приєднання з сильними кислотами, Наприклад з соляною або сірчаною кислотою.
Разом з тим бензол бере участь в цілому ряді реакцій електрофільного заміщення. Продуктами реакцій цього типу є ароматичні сполуки, Оскільки в цих реакціях зберігається делокалізованних -електронний система бензолу. Загальний механізм заміщення атома водню на бензольному кільці будь-яким електрофілом описаний в розд. 17.3. Прикладами електрофільного заміщення бензолу є його нітрація, галогенирование, сульфування і реакції Фріделя-Крафтса.
Нітрування. Бензол можна нітровані (вводити в нього групу), обробляючи його сумішшю концентрованих азотної та сірчаної кислот:

нітробензол
Умови проведення цієї реакції і її механізм описані в розд. 17.3.
Нітробензол блідо-жовта рідина з характерним мигдальним запахом. При нитровании бензолу крім нитробензола утворюються ще кристали 1,3-динітробензолу, який є продуктом наступної реакції:

Галогенування. Якщо змішати бензол в темряві з хлором або бромом, не відбудеться ніякої ракции. Однак у присутності каталізаторів, що володіють властивостями кислот Льюїса, в таких сумішах протікають реакції електрофільного заміщення. Типовими каталізаторами цих реакцій є бромід заліза (III) і хлорид алюмінію. Дія цих каталізаторів полягає в тому, що вони створюють поляризацію в молекулах галогенів, які потім утворюють комплекс з каталізатором:
хоча прямих доказів того, що при цьому утворюються вільні іони не існує. Механізм бромирования бензолу за допомогою броміду заліза (III) в ролі переносника іонів можна представити таким чином:

Сульфирование. Бензол можна сульфовані (заміщати в ньому атом водню на сульфогруппу) шляхом кип'ятіння зі зворотним холодильником протягом декількох годин його суміші з концентрованої сірчаної кислотою. Замість цього бензол можна обережно нагрівати в суміші з димить сірчаної кислотою. димить сірчана кислота містить триоксид сірки. Механізм цієї реакції можна представити схемою

Реакції Фріделя-Крафтса. Реакціями Фріделя-Крафтса спочатку називали реакції конденсації між ароматичними сполуками і алкилгалогенидами в присутності каталізатора-безводного хлориду алюмінію.
У реакціях конденсації дві молекули реагентів (або одного реагенту) з'єднуються між собою, утворюючи молекулу нового з'єднання, при цьому від них відщеплюється (елімінує) молекула якого-небудь простого з'єднання, наприклад води або хлороводню.
В даний час реакцією Фріделя-Крафтса називають будь-який електрофільне заміщення ароматичного сполуки, в якому роль електрофени грає будь-якої карбкатион або сильно поляризоване комплекс з позитивно зарядженим атомом вуглецю. Електрофільним агентом, як правило, служить алкілгалогеніду або хлорид будь-якої карбонової кислоти, Хоча точно так же їм може бути, наприклад, алкен або спирт. В якості каталізатора цих реакцій зазвичай використовується безводний хлорид алюмінію. Реакції Фріделя-Крафтса прийнято поділяти на два типи: алкілування і ацилювання.
Алкилирование. У реакціях Фріделя-Крафтса цього типу відбувається заміщення одного або декількох атомів водню в бензольному кільці на алкіли. Наприклад, при обережному нагріванні суміші бензолу з хлорометанов в присутності безводного хлориду алюмінію утворюється метилбензол. Хлорометан грає в цій реакції роль електрофільного агента. Він поляризується хлоридом алюмінію таким же чином, як це відбувається з молекулами галогенів:
Механізм даної реакції може бути представлений таким чином:

Слід звернути увагу на те, що в цій реакції конденсації між бензолом і хлорометанов відбувається відщеплення молекули хлороводню. Відзначимо також, що реальне існування метального карбкатиона у вигляді вільного іона сумнівно.
Алкілування бензолу хлорометанов в присутності каталізатора - безводного хлориду алюмінію не закінчується утворенням метилбензола. У цій реакції відбувається подальше алкілування бензольного кільця, що приводить до утворення 1,2-діметілбензола:

Ацилирование. У реакціях Фріделя-Крафтса цього типу відбувається заміщення атома водню в бензольному кільці на ацильну групу, в результаті чого утворюється ароматичний кетон.
Ацильного група має загальну формулу
Систематичне назва ацильного з'єднання утворюється шляхом заміни суфікса і закінчення -овая в назві відповідної карбонової кислоти, похідним якої є дане аціл'ное з'єднання, на суфікс - (о) мул. наприклад

Ацилирование бензолу проводиться за допомогою хлориду або ангідриду будь-якої карбонової кислоти в присутності каталізатора-безводного хлориду алюмінію. наприклад

Ця реакція являє собою конденсацію, в якій відбувається відщеплення молекули хлороводню. Відзначимо також, що назва «феніл» часто використовується для позначення бензольного кільця в з'єднаннях, де бензол не є головною групою:

Реакції приєднання. Хоча для бензолу найбільш характерні реакції електрофільного заміщення, він вступає також в деякі реакції приєднання. З одного з них ми вже познайомилися. Йдеться про гидрировании бензолу (див. Розд. 5.3). При пропущенні суміші бензолу з воднем над поверхнею тонкоизмельченного нікелевого каталізатора при температурі 150-160 ° С відбувається ціла послідовність реакцій, яка завершується утворенням циклогексану. Сумарне стехиометрическое рівняння цієї реакції можна представити таким чином:

Під дією ультрафіолетового випромінювання або прямого сонячного світла бензол вступає також в реакцію приєднання з хлором. Ця реакція здійснюється по складному радикальному механізму. Її остаточним продуктом є 1,2,3,4,5,6-гексахлороціклогексан:

Аналогічна реакція протікає між бензолом і бромом під дією ультрафіолетового випромінювання або сонячного світла.
Окислення. Бензол і бензольне кільце в інших ароматичних з'єднаннях, взагалі кажучи, стійкі до окислення навіть такими сильними окислювачами, як кислий або лужний розчин перманганату калію. Однак бензол та інші ароматичні сполуки згоряють в повітрі або в кисні з утворенням дуже димного полум'я, що характерно для вуглеводнів з високим відносним вмістом вуглецю.
Фізичні властивості
Бензол і його найближчі гомологи - безбарвні рідини із специфічним запахом. Ароматичні вуглеводні легше води і в ній не розчиняються, проте легко розчиняються в органічних розчинниках - спирті, ефірі, ацетоні.
Бензол і його гомологи самі є хорошими розчинниками для багатьох органічних речовин. Всі арени горять коптить полум'ям зважаючи на високий вміст вуглецю вих молекулах.
Фізичні властивості деяких аренів представлені в таблиці.
Таблиця. Фізичні властивості деяких аренів
|
Назва |
Формула |
t ° .пл., |
t ° .кіп., |
|
бензол |
C 6 H 6 |
5,5 |
80,1 |
|
Толуол (метилбензол) |
З 6 Н 5 СH 3 |
95,0 |
110,6 |
|
етилбензол |
З 6 Н 5 З 2 H 5 |
95,0 |
136,2 |
|
Ксилол (діметілбензол) |
З 6 Н 4 (СH 3) 2 |
||
|
орто- |
25,18 |
144,41 |
|
|
мета- |
47,87 |
139,10 |
|
|
пара- |
13,26 |
138,35 |
|
|
пропілбензолу |
З 6 Н 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
Кумол (ізопропілбензол) |
C 6 H 5 CH (CH 3) 2 |
96,0 |
152,39 |
|
Стирол (вінілбензол) |
З 6 Н 5 CH \u003d СН 2 |
30,6 |
145,2 |
бензол - легкокипящая ( t кип\u003d 80,1 ° С), безбарвна рідина, яка не розчиняється у воді
Увага! бензол - отрута, діє на нирки, змінює формулу крові (при тривалому впливі), може порушувати структуру хромосом.
Більшість ароматичних вуглеводнів небезпечні для життя, токсичні.
Отримання аренов (бензолу і його гомологів)
В лабораторії
1. Сплавлення солей бензойної кислоти з твердими лугами
C 6 H 5 -COONa + NaOH t →C 6 H 6 + Na 2 CO 3
бензоат натрію
2. Реакція Вюрца-Фиттинга: (Тут Г - галоген)
З 6H 5 -Г + 2Na + R-Г →C 6 H 5 - R + 2 NaГ
З 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
У промисловості
- виділяють з нафти і вугілля методом фракційної перегонки, риформингом;
- з кам'яновугільної смоли і коксового газу
1. дегидроциклизации алканів з числом атомів вуглецю більше 6:
C 6 H 14 t , kat→ C 6 H 6 + 4H 2
2. тримеризация ацетилену (Тільки для бензолу) - р. Зелінського:
3С 2 H 2 600 ° C , Акт. вугілля → C 6 H 6
3. дегидрированием циклогексана і його гомологів:
Радянський академік Микола Дмитрович Зелінський встановив, що бензол утворюється з циклогексану (дегидрирование циклоалканов
C 6 H 12 t, kat→ C 6 H 6 + 3H 2

C 6 H 11 -CH 3 t , kat→ C 6 H 5 -CH 3 + 3H 2
метілціклогексантолуол
4. алкілування бензолу (Отримання гомологів бензолу) - р Фріделя-Крафтса.
C 6 H 6 + C 2 H 5 -Cl t, AlCl3→ C 6 H 5 -C 2 H 5 + HCl
хлоретан етилбензол

Хімічні властивості аренів
I. РЕАКЦІЇ ОКИСЛЕННЯ
1. Горіння (закіптюжений полум'я):
2C 6 H 6 + 15O 2 t → 12CO 2 + 6H 2 O + Q
2. Бензол при звичайних умовах не знебарвлює бромную воду і водний розчин марганцівки
3. Гомологи бензолу окислюються перманганатом калію (обесцвечивают марганцівку):
А) в кислому середовищі до бензойної кислоти
При дії на гомологи бензолу перманганату калію та інших сильних окислювачів бічні ланцюга окислюються. Якою б складною не була ланцюг заступника, вона руйнується, за винятком a -атома вуглецю, який окислюється в карбоксильну групу.
Гомологи бензолу з однією бічним ланцюгом дають бензойну кислоту:
Гомологи, що містять дві бічні ланцюги, дають двохосновні кислоти:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
спрощено :
C 6 H 5 -CH 3 + 3O KMnO4→ C 6 H 5 COOH + H 2 O
Б) в нейтральній і слабощелочной до солей бензойної кислоти
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COOДо + K ОН + 2MnO 2 + H 2 O
II. РЕАКЦІЇ ПРИЄДНАННЯ (Важче, ніж у алкенів)
1. Галогенування
C 6 H 6 + 3Cl 2 h ν → C 6 H 6 Cl 6 (Гексахлорциклогексан - гексахлоран)
2. Гідрування
C 6 H 6 + 3H 2 t , Pt або Ni → C 6 H 12 (Циклогексан)
3. Полімеризація
III. РЕАКЦІЇ ЗАМІЩЕННЯ - іонний механізм (Легше, ніж у алканів)
б) гомологів бензолу при опроміненні або нагріванні
За хімічними властивостями алкільні радикали подібні алканів. Атоми водню в них заміщуються на галоген по вільно-радикальному механізму. Тому за відсутності каталізатора при нагріванні або УФ-опроміненні йде радикальна реакція заміщення в бічному ланцюзі. Вплив бензольного кільця на алкільні заступники призводить до того, що заміщується завжди атом водню у атома вуглецю, безпосередньо пов'язаного з бензольні кільцем (a -атома вуглецю).
1) C 6 H 5 -CH 3 + Cl 2 h ν → C 6 H 5 -CH 2 -Cl + HCl
в) гомологів бензолу в присутності каталізатора
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (суміш орта, пара похідних) + HCl
2. Нітрування (з азотною кислотою)
C 6 H 6 + HO-NO 2 t, H2SO4→ C 6 H 5 -NO 2 + H 2 O
нітробензол - запах мигдалю!
C 6 H 5 -CH 3 + 3HO-NO 2 t, H2SO4→ З H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-тринітротолуол (тол, тротил)
Застосування бензолу і його гомологів
бензол C 6 H 6 - хороший розчинник. Бензол як добавка покращує якість моторного палива. Служить сировиною для отримання багатьох ароматичних органічних сполук - нитробензола C 6 H 5 NO 2 (розчинник, з нього отримують анілін), хлорбензолу C 6 H 5 Cl, фенолу C 6 H 5 OH, стиролу і т.д.
толуол C 6 H 5 -CH 3 - розчинник, використовується при виробництві барвників, лікарських і вибухових речовин (тротил (тол), або 2,4,6-тринітротолуол ТНТ).
ксилолиC 6 H 4 (CH 3) 2. Технічний ксилол - суміш трьох ізомерів ( орто-, мета- і пара-ксілолов) - застосовується як розчинник і вихідного продукту для синтезу багатьох органічних сполук.
ізопропілбензол C 6 H 5 -CH (CH 3) 2 служить для отримання фенолу і ацетону.
Хлорпохідні бензолу використовують для захисту рослин. Так, продукт заміщення в бензолі атомів Н атомами хлору - гексахлорбензол З 6 Сl 6 - фунгіцид; його застосовують для сухого протруювання насіння пшениці та жита проти твердої сажки. Продукт приєднання хлору до бензолу - гексахлорциклогексан (гексахлоран) З 6 Н 6 Сl 6 - інсектицид; його використовують для боротьби зі шкідливими комахами. Згадані речовини відносяться до пестицидів - хімічних засобів боротьби з мікроорганізмами, рослинами і тваринами.
Стирол C 6 H 5 - CH \u003d CH 2 дуже легко полімеризується, утворюючи полістирол, а сополімерізуясь з бутадієном - бутадіенстірольние каучуки.
ВІДЕО-ДОСВІДИ
Ароматичні УВ (арени) - це УВ, молекули яких містять одну або кілька бензольних кілець.
Приклади ароматичних УВ:

Арени ряду бензолу (моноциклічні арени)
Загальна формула:C n H 2n-6, n≥6
Найпростішим представником ароматичних УВ є бензол, його емпірична формула З 6 Н 6.
Електронна будова молекули бензолу
Загальна формула моноциклических аренов C n H 2 n -6 показує, що вони є ненасиченими сполуками.
У 1856 р німецький хімік А.Ф. Кекуле запропонував циклічну формулу бензолу з сполученими зв'язками (чергуються прості і подвійні зв'язку) - ціклогексатріен-1,3,5: 
Така структура молекули бензолу не пояснювала багато властивостей бензолу:
- для бензолу характерні реакції заміщення, а не реакції приєднання, властиві ненасичених сполук. Реакції приєднання можливі, але протікають важче, ніж для;
- бензол не вступає в реакції, що є якісними реакціями на ненасичені УВ (з бромної водою і розчином КМnО 4).
Проведені пізніше електронографічні дослідження показали, що всі зв'язки між атомами вуглецю в молекулі бензолу мають однакову довжину 0,140 нм (середнє значення між довжиною простий зв'язку С-С 0,154 нм і подвійного зв'язку С \u003d С 0,134 нм). Кут між зв'язками у кожного атома вуглецю дорівнює 120 о. Молекула являє собою правильний плоский шестикутник.
Сучасна теорія для пояснення будови молекули З 6 Н 6 використовує уявлення про гібридизації орбіталей атома.
Атоми вуглецю в бензолі знаходяться в стані sp 2-гібридизації. Кожен атом «С» утворює три σ-зв'язку (дві з атомами вуглецю і одну з атомом водню). Все σ-зв'язку знаходяться в одній площині:
Кожен атом вуглецю має один р-електрон, який не бере участі в гібридизації. Негібрідізованние р-орбіталі атомів вуглецю знаходяться в площині, перпендикулярній площині σ-зв'язків. Кожне р-хмара перекривається з двома сусідніми р-хмарами, і в результаті утворюється єдина сполучена π-система (згадайте ефект сполучення р-електронів в молекулі бутадієну-1,3, розглянутий в темі «Дієнові вуглеводні»):
Поєднання шести σ-зв'язків з едіой π-системою називається ароматичної зв'язком.
Цикл з шести атомів вуглецю, пов'язаних ароматичної зв'язком, називається бензольні кільцем,або бензольні ядром.
Відповідно до сучасних уявлень про електронну будову бензолу молекулу З 6 Н 6 зображують наступним чином:

Фізичні властивості бензолу
Бензол при звичайних умовах - безбарвна рідина; t o пл \u003d 5,5 о С; t o кип. \u003d 80 о С; має характерний запах; не змішується з водою, хороший розчинник, сильно токсичний.
Хімічні властивості бензолу
Ароматична зв'язок визначає хімічні властивості бензолу та інших ароматичних УВ.
6π-електронна система є більш стійкою, ніж звичайні двухелектроіние π-зв'язку. Тому реакції приєднання менш характерні для ароматичних УВ, ніж для ненасичених УВ. Найбільш характерними для аренів є реакції заміщення.
I. реакції заміщення
1.Галогенірованіе

2. нітрування
Реакцію здійснюють сумішшю і кислот (нітрит суміш): 
3.Сульфірованіе

4.Алкілірованіе (Заміщення атома «Н» на алкільних груп) - реакції Фріделя-Крафтса, Утворюються гомологи бензолу:

Замість галогеналканов можна використовувати алкени (у присутності каталізатора - AlCl 3 або неорганічної кислоти):

II. реакції приєднання
1.Гідрірованіе

2.Прісоедіненіе хлору

III. реакції окислення
1. Горіння
2С 6 Н 6 + 15О 2 → 12СО 2 + 6Н 2 О
2. Неповне окислення (KMnO 4 або K 2 Cr 2 O 7 в кислому середовищі). Бензольне кільце стійко до дії окислювачів. Реакція не відбувається.
отримання бензолу
У промисловості:
1) переробка нафти і вугілля;
2) дегидрирование циклогексана:

3) дегидроциклизация (ароматизація) гексана:

В лабораторії:
Сплавлення солей бензойної кислоти з:

Ізомерія і номенклатура гомологів бензолу
Будь-гомолог бензолу має бічний ланцюг, тобто алкільні радикали, пов'язані з бензольні ядром. Перший гомолог бензолу є бензольне ядро, пов'язане з метильних радикалом: 
Толуол не має ізомерів, оскільки всі положення в бензольному ядрі рівноцінні.
Для подальших гомологів бензолу можливий один вид ізомерії - ізомерія бічного ланцюга, яка може бути двох видів:
1) ізомерія числа і будови заступників;
2) ізомерія положення заступників.



Фізичні властивості толуолу
толуол - безбарвна рідина з характерним запахом, що не розчинна у воді, добре розчиняється в органічних розчинниках. Толуол менш токсичний, ніж бензол.
Хімічні властивості толуолу
I. реакції заміщення
1.Реакціі за участю бензольного кільця
Метилбензол вступає в усі реакції заміщення, в яких бере участь бензол, і проявляє при цьому більш високу реакційну здатність, реакції протікають з більшою швидкістю.
Радикал, що міститься в молекулі толуолу, є заступником роду, тому в результаті реакцій заміщення в бензольному ядрі виходять орто- і пара-похідні толуолу або при надлишку реагенту - тріпроізводние загальної формули:

а) галогенирование


При подальшому хлоруванні можна отримати діхлорметілбензол і тріхлорметілбензол:

II. реакції приєднання
гідрування

III.реакції окислення
1.Гореніе
C 6 H 5 CH 3 + 9O 2 → 7CO 2 + 4H 2 O
2. Неповне окислення
На відміну від бензолу його гомологи окислюються деякими окислювачами; при цьому окисленню піддається бічний ланцюг, в разі толуолу - метильная група. М'які окислювачі типу MnO 2 окислюють його до альдегідної групи, більш сильні окислювачі (KMnO 4) викликають подальше окислення до кислоти: 
Будь-гомолог бензолу з однією бічним ланцюгом окислюється сильним окислювачем типу KMnO4 в бензойну кислоту, тобто відбувається розрив бічного ланцюга з окисленням отщепа частини її до СО 2; наприклад: 
При наявності декількох бічних ланцюгів кожна з них окислюється до карбоксильної групи і в результаті утворюються багатоосновні кислоти, наприклад:

Отримання толуолу:
У промисловості:
1) переробка нафти і вугілля;
2) дегидрирование метілціклогексана:

3) дегидроциклизация гептана:
В лабораторії:
1) алкілування по Фриделю-Крафтс;
2) реакція Вюрца-Фіттіга (Взаємодія натрію з сумішшю галогенбензолів і галогеналкани).
Перша група реакцій реакції заміщення. Ми говорили, що арени не мають кратних зв'язків в структурі молекули, а містять пов'язану систему з шести електронів, яка дуже стабільна і надає додаткову міцність бензольного кільця. Тому в хімічних реакціях відбувається в першу чергу заміщення атомів водню, а не руйнування бензольного кільця.
З реакціями заміщення ми вже стикалися при розмові про алканах, але для них ці реакції йшли по радикальному механізму, а для аренов характерний іонний механізм реакцій заміщення.
першехімічне властивість галогенирование. Заміщення атома водню на атом галогену хлору або брому.
Реакція йде при нагріванні і обов'язково за участю каталізатора. У випадку з хлором це може бути хлорид алюмінію або хлорид заліза три. Каталізатор поляризує молекулу галогену, в результаті чого відбувається гетеролітичною розрив зв'язку і виходять іони.
Позитивно заряджений іон хлору і вступає в реакцію з бензолом.
Якщо реакція відбувається з бромом, то каталізатором виступає бромід заліза три або бромід алюмінію.

Важливо відзначити, що реакція відбувається з молекулярним бромом, а не з бромної водою. З бромной водою бензол не реагує.
У галогенування гомологів бензолу є свої особливості. У молекулі толуолу метильная група полегшує заміщення в кільці, реакційна здатність підвищується, і реакція йде в більш м'яких умовах, тобто вже при кімнатній температурі.

Важливо відзначити, що заміщення завжди відбувається в орто- і пара-положеннях, тому виходить суміш ізомерів.
Другевластивість нітрація бензолу, введення нітрогрупи в бензольне кільце.
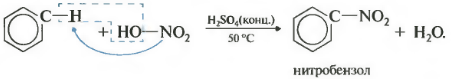
Утворюється важка жовтувата рідина з запахом гіркого мигдалю нітробензол, тому реакція може бути якісною на бензол. Для нітрування використовується нітрит суміш концентрованої азотної і сірчаної кислот. Реакція проводиться при нагріванні.
Нагадаю, що для нітрування алканів в реакції Коновалова використовувалася розбавлена азотна кислота без додавання сірчаної.
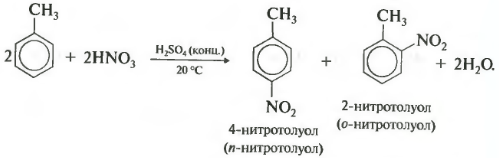
При нитровании толуолу, також як і при Галогенування, утворюється суміш орто- і пара- ізомерів.
третєвластивість алкілування бензолу галогеналканами.
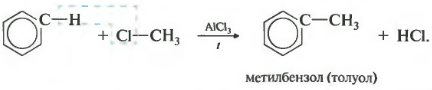
Ця реакція дозволяє ввести вуглеводневий радикал в бензольне кільце і може вважатися способом отримання гомологів бензолу. В якості каталізатора використовується хлорид алюмінію, що сприяє розпаду молекули галогеналкани на іони. Також необхідно нагрівання.
четвертевластивість алкілування бензолу алкенами.

Таким способом можна отримати, наприклад, кумол або ж етилбензол. Каталізатор хлорид алюмінію.
2. Реакції приєднання до бензолу
Друга група реакцій реакції приєднання. Ми говорили, що ці реакції не характерні, але вони можливі при досить жорстких умовах з руйнуванням пі-електронної хмари і утворенням шести сигма-зв'язків.
п'ятевластивість в загальному списку гідрування, приєднання водню.
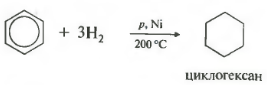
Температура, тиск, каталізатор нікель або платина. Таким же чином здатний реагувати толуол.
шостевластивість хлорування. Зверніть увагу, що мова йде саме про взаємодію з хлором, оскільки бром в цю реакцію не вступає.
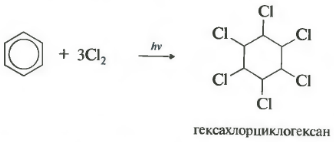
Реакція протікає при жорсткому ультрафіолетовому опроміненні. Утворюється гексахлорциклогексан, інша назва гексахлоран, тверда речовина.
Важливо пам'ятати, що для бензолу неможливі реакції приєднання галогеноводородов (гідрогалогенірованіе) і приєднання води (гідратація).
3. Заміщення в бічному ланцюзі гомологів бензолу
Третя група реакцій стосується тільки гомологів бензолу це заміщення в бічному ланцюзі.
сьомевластивість в загальному списку галогенирование по альфа-атому вуглецю в бічному ланцюзі.

Реакція відбувається при нагріванні або опроміненні і завжди тільки по альфа-вуглецю. При продовженні галогенування, другий атом галогену знову встане в альфа-положення.
4. Окислення гомологів бензолу
Четверта група реакцій окиснення.
Бензольне кільце занадто міцне, тому бензол що не окислюється перманганатом калію НЕ знебарвлює його розчин. Це дуже важливо пам'ятати.
Зате гомологи бензолу окислюються підкисленим розчином перманганату калію при нагріванні. І це є восьме хімічне властивість.

Виходить бензойна кислота. Спостерігається знебарвлення розчину. При цьому, якою б довгою була вуглецевий ланцюг заступника, завжди відбувається її розрив після першого атома вуглецю і альфа-атом окислюється до карбоксильної групи з утворенням бензойної кислоти. Частина, що залишилася молекули окислюється до відповідний кислоти або, якщо це тільки один атом вуглецю, до вуглекислого газу.
Якщо гомолог бензолу має більше одного вуглеводневої заступника у ароматичного кільця, то окислення відбувається за тими ж правилами окислюється вуглець, що знаходиться в альфа-положенні.

В даному прикладі виходить двухосновная ароматична кислота, яка називається фталева кислота.
Особливим чином зазначу окислення кумолу, изопропилбензола, киснем повітря в присутності сірчаної кислоти.
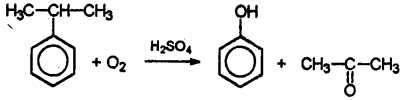
Це так званий кумольним спосіб отримання фенолу. Як правило, стикатися з цією реакцією доводиться в питаннях, що стосуються отримання фенолу. Це промисловий спосіб.
Дев'ятевластивість горіння, повне окислення киснем. Бензол і його гомологи згоряють до вуглекислого газу і води.
Запишемо рівняння горіння бензолу в загальному вигляді.
Згідно із законом збереження маси атомів зліва має бути стільки ж, скільки атомів справа. Тому що адже в хімічних реакціях атоми нікуди не діваються, а просто змінюється порядок зв'язків між ними. Так ось молекул вуглекислого газу буде стільки ж, скільки і атомів вуглецю в молекулі арена, оскільки до складу молекули входить один атом вуглецю. Тобто n молекул CO 2. Молекул води буде в два рази менше, ніж атомів водню, тобто (2n-6) / 2, а значить n-3.
Атомів кисню зліва і справа однакову кількість. Справа їх 2n з вуглекислого газу, тому що в кожній молекулі два атоми кисню, плюс n-3 з води, разом 3n-3. Зліва атомів кисню стільки ж 3n-3, а значить молекул в два рази менше, тому як до складу молекули входять два атоми. Тобто (3n-3) / 2 молекул кисню.
Таким чином, ми склали рівняння згоряння гомологів бензолу в загальному вигляді.
Схожі статті
-
Skyrim - Фікс вильотів при завантаженні збереження Завантажити мод на Скайрім краш фікс
Примітка: Якщо ви відчуваєте проблеми після установки (вильоти при відкритті меню, збільшення підвисань, графічні неполадки, тоді спробуйте вписати "EnableOnlyLoading \u003d true" в data / SKSE / Plugins / SafetyLoad.ini. Це змусить ...
-
Що вище місяця. Вище місяця. Спеціально для групи world of different books переклади книг
Висока і низька Місяць сайт - "Спостерігач" 22-07-2007 Влітку повний Місяць над горизонтом ходить низько над горизонтом. Іноді її важко розглянути за деревами і будівлями. Кожна людина знає, що фаза Місяця змінюється день у день. Ось ...
-
Видано указ про створення колегій
Всю державну діяльність Петра I умовно можна розділити на два періоди: 1695-1715 роки та 1715-1725. Особливістю першого етапу були поспіх і не завжди продуманий характер, що пояснювалося веденням Північної війни. Реформи були ...
-
Громадянська війна - Брати Бурі
Після недовгого ради з Галмар, ярл Ульфрік віддасть наказ штурмувати непокірне місто. Нас він відсилає до табору, який Брати Бурі вже розбивають неподалік від Вайтрана (при цьому саме місто з карти пропаде, щоб не було спокуси ...
-
Квест «Без вісті зниклий»: «Скайрім»
Звільнити Торальда в Скайрім виникає необхідність в сторонньому квесті фракції Сірі Гриви. Сам квест почнеться після діалогу з фрейле Сіра Голова в Вайтране, та розповість Довакін, що її син живий, хоч чутки ходять прямо ...
-
Skyrim - Магія Як знайти заклинання в Скайріме
Магія - невід'ємна частина світу Нірн, вона дозволяє управляти стихіями, закликати істот, зцілювати рани, змінювати матерію і створювати ілюзії. Все це доступно для вивчення і в Скайріме. Щоб подивитися доступні вам заклинання, ...